科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-20
来源:病毒学界
截至2020年9月20日,全球累计感染人数超过3000万,95万多人因感染新冠病毒死亡。ACE2受体是新冠病毒的关键入侵门径,ACE2与刺突蛋白的结合直接决定了传染性和致病力。之前的研究揭示了新冠病毒刺突蛋白三聚体的结构,中心的3个S2亚基形成螺旋柄状,顶部由S1亚基覆盖。在病毒包膜中,刺突蛋白表现为封闭的形式,S1亚基受体结合结构域(RBD)与S2的核心区结合;而与ACE2结合时,RBD区域暴露并介导病毒的膜融合。进一步的研究解析了ACE2与RBD相互作用界面的结构,然而完整的ACE2-S蛋白结构以及动态的膜融合过程还有待解析(参看推荐阅读)。近日,弗朗西斯·克里克研究所的Gamblin团队在国际顶级期刊Nature上发表了题为“Receptor binding and priming of the spikeprotein of SARS-CoV-2 for membrane fusion”的研究论文,利用冷冻电镜技术解析了蛋白酶切加工的刺突蛋白与ACE2结合的精细动态过程,阐明了新冠病毒感染细胞的起始阶段。
 标题
标题
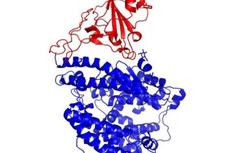
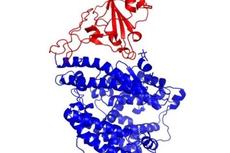
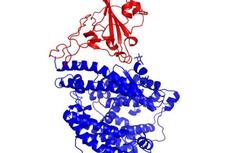
研究者首先将furin酶切的刺突蛋白和ACE2的胞外区混合并冷冻为单颗粒,利用低温电镜解析结构。结果发现了十种不同的蛋白复合体构象,包括紧密结合构象、开放构象以及未结合状态。
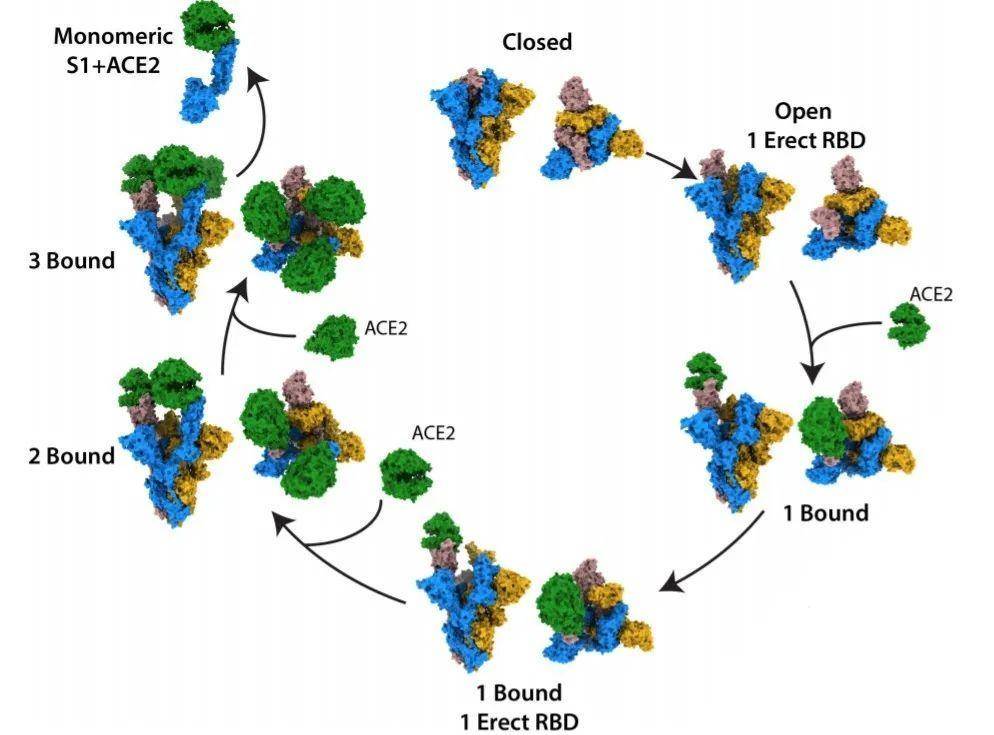 ACE2-S复合体不同构象
ACE2-S复合体不同构象
通过比较ACE2结合前后的S蛋白三聚体及RBD区,研究者发现ACE2结合通过结构域刚体旋转的方式改变了RBD的位置,这与中和抗体的结合很类似。同时,更多数量的ACE2结合三聚体并不能诱导更大的构象改变。其次,ACE2-S蛋白的结合需要开放的构象以促进两者的结合,该过程伴随着S1亚基间接触面的减少,这些是病毒膜融合所必需的。研究者深入分析了参与不同构象形成的关键氨基酸残基和相互作用机制。特别是614位天冬氨酸经常发生甘氨酸的替换(所谓的“D614G”),降低了封闭构象的稳定性,增加RBD结构域与ACE2的结合概率,从而促进病毒表面与细胞膜融合。
 结合机制及关键氨基酸
结合机制及关键氨基酸
研究者发现在封闭-开放构象转变过程中,S2亚基HR1区段暴露出来,经历螺旋重排的变构,直接介导了病毒包膜与细胞膜的融合。研究者也观察到在RBD和ACE2亚结构域及NTD段有大幅度的重排,ACE2与S蛋白单体也能够结合,因此推测ACE2-刺突蛋白复合体是亚稳态的。
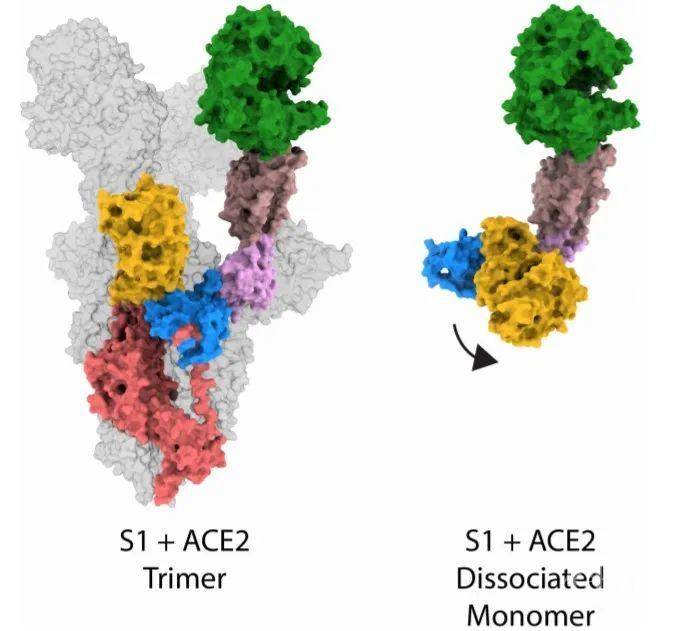 三聚体与单体
三聚体与单体
该研究揭示了ACE2与RBD结合的动态分子过程,指出了S蛋白三聚体是螺旋重排和细胞膜融合的起始步骤,为设计融合肽抑制剂等药物提供了思路和基础。
来源:viramedia 病毒学界
原文链接:https://mp.weixin.qq.com/s?__biz=MzIyMzQ3NTMyMQ==&mid=2247501246&idx=1&sn=3e77f325e9b79746628edfd4d8d9d18e&chksm=e81f26a8df68afbe2076754a674387de6c078f60f7ed904a85ee6fb7b0519a96957f6ba9a2d4#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
全球首发:复旦大学发现SARS病毒单抗可用于新型冠状病毒肺炎治疗

【科技前沿】严景华/齐建勋首次发现新冠病毒进入细胞的详细分子细节
中科院微生物所首次解析新冠病毒S蛋白 RBD与人受体 ACE2 蛋白复合体结构

【专家科普】拳打脚踢的睡眠-RBD
为何说新冠病毒的实验室起源论是不足信的?|《自然-医学》
新冠病毒S蛋白受体结合区域(RBD)与人受体ACE2复合物结构
【学术前沿】新冠病毒S蛋白受体结合区域(RBD)与人受体ACE2复合物结构
不结合RBD的抗体也能中和SARS-CoV-2
新冠病毒S蛋白受体结合区域(RBD)与人受体ACE2复合物结构

《自然》:新冠病毒S-RBD疫苗可诱导保护性免疫反应