科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-18
来源:南京大学
化疗作为肿瘤治疗的主要手段之一,由于其传递效率低、副作用大及多重耐药性(multidrug-resistance,MDR)而受到限制。其中,MDR会导致肿瘤细胞药物外排,从而造成肿瘤抑制效率低和肿瘤复发。因此,寻找克服肿瘤细胞MDR的有效方法对提高肿瘤治愈率具有重要意义。朱俊杰教授课题组近期在DNA多功能纳米载体用于MDR肿瘤的治疗研究中取得重要进展,其研究论文“Multifunctional DNA Polycatenane Nanocarriers for Synergistic Targeted Therapy of Multidrug-Resistant Human Leukemia”近日在线发表在材料领域的重要刊物Advanced Functional Materials(DOI: 10.1002/adfm.201905659)上。
DNA作为一种生物内源性物质,具有序列可编程性、自动控制合成、易于修饰等特点。基于DNA构建的纳米结构已广泛应用于生物医学领域。尽管已有大量有关DNA纳米结构作为药物载体的研究报道,但是受DNA结构稳定性的限制,抗肿瘤效果欠佳。近期,朱俊杰教授课题组与青岛大学毕赛教授合作,构建了一种多功能适配体-DNA聚环结构(AptDPCs),联合化疗和基因治疗,协同治疗人耐药白血病。此外,该工作引入磁分离技术,实现DNA纳米结构的高效纯化和磁性载体的循环使用。
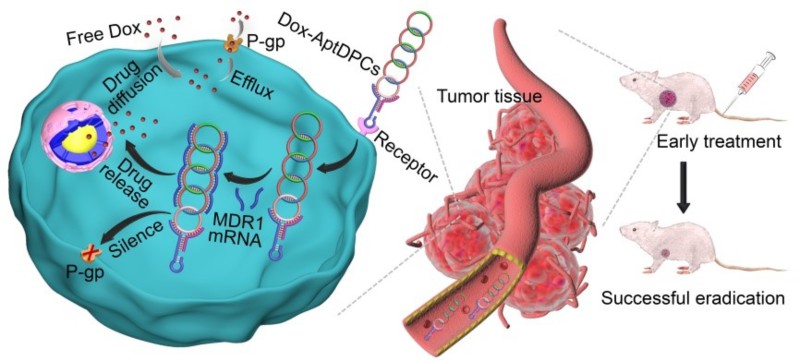
图1. 多功能适配体-DNA聚环结构靶向协同治疗(化疗和基因治疗)人耐药白血病
该工作自组装得到的AptDPCs具有较高的长径比,且其刚性结构能够抵抗核酸酶的降解,具有良好的生物稳定性。此外,该工作成功采用荧光基团、载药位点和反义寡链核苷酸(AS ODN)等对AptDPCs进行功能化,实现了MDR肿瘤细胞的生物成像、靶向药物递送及基因治疗。如图1所示,当负载阿霉素(Dox)的AptDPCs(Dox-AptDPCs)被MDR人白血病细胞(K562/D)特异性摄取后,Dox在胞质中逐渐释放,同时AS ODN与MDR1 mRNA杂交,抑制P-gp的表达,防止Dox泵出细胞,提高Dox在肿瘤细胞中的累积量,有效抑制肿瘤生长。体外和体内研究证实,在化疗和基因治疗的协同作用下,AptDPCs不仅可以实现靶向药物递送,显著降低系统毒副作用,而且可以有效增强MDR肿瘤的化疗效果,为MDR肿瘤靶向纳米治疗平台的开发开辟了新的途径。
化学化工学院2017级博士生于莎同学为论文的第一作者,姜立萍教授、毕赛教授和朱俊杰教授为论文共同通讯作者,南京大学为第一通讯单位。此项研究得到了国家自然科学基金、科技部国际合作基金等项目的支持。

国家纳米中心在基于DNA纳米机器的肿瘤疫苗研究中获进展

DNA“纳米转运蛋白”或可高效治癌
第一届纳米纤维素材料国际研讨会在杭州召开



DNA纳米机器人响应体内分子触发靶向肿瘤治疗
首个DNA材料制成的纳米马达面世
国纳中心丁宝全团队在基于DNA纳米机器的肿瘤疫苗取得进展
百余根硅纳米线阵列监测循环肿瘤DNA
王艳丽:做研究就像破案

DNA纳米医用器件研究取得进展

【走近桂籍科学家】用纳米武装电池新世界