科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-24
来源:中国科学院
北京时间2019年3月1日凌晨,国际顶尖学术期刊《细胞》以长文的形式在线发表了美国哈佛医学院JamesJ. Chou教授和Hao Wu教授研究组的最新研究成果“Higher-order clustering of the transmembrane anchor of DR5 drives signaling”。该研究通过核磁共振技术解析了肿瘤坏死因子受体超家族中的死亡受体5(DR5)的跨膜区的溶液结构,发现其可以形成独特的二聚并三聚(Dimer-Trimer)多体相互作用的高级结构簇(如图1所示),这一高级结构簇可以直接驱动肿瘤细胞内的下游信号传导。

图1:DR5的跨膜螺旋形成高级结构簇驱动了下游细胞信号传导的模型示意图。
细胞膜上的受体聚集在许多免疫受体的信号传导中是关键的,并且该机制先前已归因于细胞外和/或细胞内相互作用。在这里,研究者们报告了一个意外的发现,肿瘤坏死因子受体超家族中的死亡受体DR5,受体中单独的跨膜螺旋(TMH)可以直接组装成高级结构簇,得以驱动受体细胞内的信号传导,并且这种结构是被没有配体化的胞外结构域抑制。此研究利用先进的液体核磁共振技术,在类似细胞膜的磷脂双分子层Bicelle中,解析了DR5TMH的高级结构。 核磁NOE数据显示出明显的三聚化和二聚化界面面(如图2所示),允许形成二聚并三聚的高级相互作用,从而形成高级结构簇。
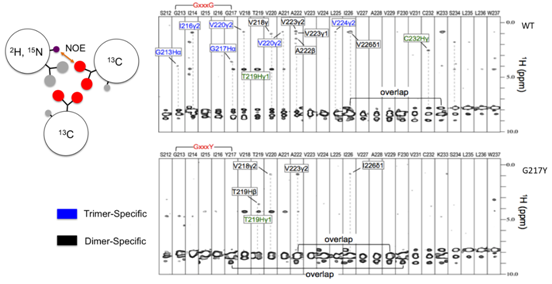
图2:通过核磁共振分子间NOE实验数据确定DR5 TMH的高级结构簇最小单元的二聚化(黑色)并三聚化(蓝色)氨基酸位点。
研究组通过TMH上关键位点的突变实验发现,破坏三聚化或二聚化的点突变,可以消除配体诱导的受体激活功能。令人惊讶的是,细胞学实验表明,在不存在配体的情况下,除去DR5胞外结构域的情况下,也可以完全激活下游信号传导。DR5细胞外的结构域在没有结合配体的情况下,抑制了DR5 TMH的高级结构簇形成,从而抑制受体活化。细胞外的配体与受体结合有助于克服配体结合前的受体自抑制状态。
该研究表明了一种受体激活的新机制:不像传统的由细胞外或者细胞内结构域的多聚化介导的受体活化,一些肿瘤坏死因子受体家族的受体的跨膜区可以单独形成高级结构簇,从而足以驱动被没有结合受体的胞外结构域抑制的细胞信号传导。同时,该研究也为Receptor Biology领域引入了一个新概念:单次跨膜区域在受体信号传递过程中可以起到关键作用,是不能被忽略的区域。
该文章有四位共同第一作者,分别是哈佛医学院的潘利强博士、Tianmin Fu博士、赵琳琳博士和浙江大学的赵文斌博士。美国哈佛医学院Hao Wu教授和浙江大学陈枢青教授是共同通讯作者。该研究工作获得国家蛋白质科学研究(上海)设施核磁系统刘志军博士的大力支持,他帮助在900兆核磁谱仪上采集了多套NOE数据(如图2所示),该数据对于确定DR5二聚并三聚的高级结构簇至关重要。该研究工作受到中国国家科技重大专项、中国国家自然科学基金和美国NIH研究经费的资助。 (蛋白质设施供稿)
文章链接:https://www.cell.com/cell/fulltext/S0092-8674(19)30150-3
Pan L^, Fu T-M^, Zhao W^, Zhao L^, Chen W, Qiu C, Liu W, Liu Z, Piai A, Fu Q, Chen S*, Wu H*, and Chou JJ*: Higher-Order Clustering of the Transmembrane Anchor of DR5 Drives Signaling. Cell, February 28, 2019, DOI:https://doi.org/10.1016/j.cell.2019.02.001

人工智能预测蛋白质结构(新知)

CopulaNet:深度学习蛋白质结构预测新进展
Nature | 为生物大分子的特异性标记提供理论基础——含炔烃氨基酸的生物合成

用突变基因,解码蛋白质结构
从预测进化 AI能“构想”新蛋白质结构

特别推荐丨生物标志物与抗肿瘤药物研发

丙肝病毒关键蛋白质结构图绘成
Nature子刊:利用蛋白质快速光化学氧化与质谱连用解析蛋白质高级结构
AlphaFold 2再发350000种蛋白质结构预测结果,解锁98.5%人类蛋白质组!
王志珍会长致2015年国际蛋白质学会“青年科学家奖”获奖者颜宁的贺信