科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-27
来源:BioArt
人体每天要呼入数千升的有菌空气,但肺部在很大程度上维持无炎症和无病原体的状态。虽然吸入的细菌被认为主要在上呼吸道和导气管中被过滤,但在肺泡中仍可以检测到气溶胶病原体。免疫系统如何应对这种程度的病原体入侵,目前仍不清楚。利用肺部感染实验模型,发现大的接种物或高毒力的细菌病原体导致强烈的炎症反应,特征是上皮细胞和驻留的巨噬细胞招募中性粒细胞,中性粒细胞吞噬并清除吸入的病原体,随后肺部恢复到稳态【1】。这种强烈的炎症反应会导致组织损伤、上皮细胞损伤和血管渗漏增加,严重者导致肺功能不全甚至死亡【2】。明显地,这种强烈的炎症反应不适用于每天的呼吸过程中,那么在不发生中性粒细胞浸润和持续的炎症的情况下,侵入肺泡空间的细菌如何被清除?
稳态条件下,肺泡巨噬细胞(AMs)是人类和小鼠肺泡中的主要免疫细胞,基本不存在中性粒细胞等炎症性细胞。AMs是由胎肝单核细胞分化而来,具有寿命长、能自我更新等特点。AMs可通过清除内源蛋白质(如表面活性蛋白surfactants和细胞碎片)和去除死细胞消除炎症来维持体内平衡。一些功能研究表明,肺部感染高致病性病原体时,AMs具有高度促炎特性,招募中性粒细胞和其他炎性免疫细胞。和其他组织驻留巨噬细胞一样,AMs在组织内缺乏运动性,被固定在肺泡内【3】。这就导致一个问题,如果每3个肺泡只有1个AM,那么当细菌在吸入后如果粘附在没有AMs的肺泡中,那么病原体就能够在没有免疫抵抗的情况下增殖。一旦细菌增殖,就需要招募中性细胞等,炎性细胞不断渗透到肺泡腔导致持续的炎症。而这种情况显然与每天呼吸有菌空气却维持免疫稳态违背,这提示AMs可能比我们预期的更加具有动态性。
近日,来自加拿大卡尔加里大学的Ajitha Thanabalasuriar和Paul Kubes在Cell 杂志上发表文章Patrolling Alveolar Macrophages Conceal Bacteria from the Immune System to Maintain Homeostasis,开发出肺泡的实时活体成像技术,揭示出肺泡巨噬细胞AMs利用Kohn孔在肺泡内和肺泡之间移动。而且,AMs通过趋化性感应、高效分解吞噬的细菌病原体,如铜绿假单胞菌和金黄色葡萄球菌等,从而使中性粒细胞不被招募。损伤AM对细菌的趋化性,则诱导中性粒细胞的过度招募,造成过度的炎症和组织损伤。此外,流感病毒A感染可通过II型干扰素信号通路损伤AM的移动,大大增加继发性细菌感染。

肺部的整体切片显示,并非每个肺泡都含有AMs,量化发现多达60%的肺泡没有AMs保护。研究人员利用AM的持续性吞噬特性,使用PKH26染料颗粒直接注入肺部进行标记,发现97%的PKH26标记细胞都是AMs,而90%的AM都被标记了。进一步定位发现,100%的PKH-AM位于肺泡侧,且很多肺泡没有PKH-AM。实时观察发现,PKH-AM可跨越几个肺泡的长度移动较长的距离;在2h的观察中,40% AM的爬行距离超过30um,10%是完全静止,其余都有一个显著的移动量(<30um)。PKH-AMs的移动速度约为0.8um/min,移动缺乏方向性,在两个肺泡之间通过Kohn孔进出。PKH-AMs的移动依赖于其自身表达的CD11a/LFA-1分子,缺失或阻断LFA-1显著降低AMs的移动,对AMs在肺部的分布没有影响。功能检测发现,LFA-1 KO小鼠的肺泡灌洗液(BALF)中细胞碎片显著增加、总胆固醇发生变化,而蛋白水平没有变化,总体上BALF混浊度显著增加,AM功能受损。
那么,AMs如何响应病原体的入侵?利用GFP标记的铜绿假单胞菌(P. aerugunosa)直接注入小鼠肺部,发现浓度为10(4次方)-10(6次方)时,明显观察到P. aerugunosa+ AMs。在感染30min到2h之间,AMs是捕获吸入P. aerugunosa的主要免疫细胞,而中性粒细胞等非AM免疫细胞内较少含有P. aerugunosa。去除AMs,则总中性粒细胞和P. aerugunosa+ 中性粒细胞的数量都显著增加,肺泡中游离的P. aerugunosa增加。即吸入细菌到达肺泡后,邻近的PKH-AMs向其移动并吞噬,整个过程依赖于AM移动行为,破坏LFA-1关键分子显著减少P. aerugunosa+ AMs。研究人员猜想趋化性或导致AMs向细菌移动,于是利用PTx阻断大多数趋化剂介导的信号传导。阻断趋化作用对稳态条件下AMs的移动、数量和分布没有影响,但显著增加P. aerugunosa感染时肺泡中游离的细菌,减少P. aerugunosa+ AMs。RNA测序显示,AMs高表达C5a受体(C5ar1)和甲酰化肽受体(Fpr1、Fpr2),或利用C5a和甲酰化肽作为趋化因子。利用C3敲除小鼠或C5ar1阻断抗体显著减少P. aerugunosa+ AMs,并增加肺泡中游离的细菌;而FPR-1缺失能与C5ar1阻断抗体协同降低AM的趋化行为。阻断AM的趋化信号导致BALF里中性粒细胞特异性趋化因子MIP-2和KC、促炎性细胞因子IL-6、中性粒细胞发育的重要细胞因子G-CSF、GM-CSF增加,同时BALF中渗漏的蛋白质、中性粒细胞浸润和炎症增加,P. aerugunosa数量增加。
之前的研究表明流感感染能改变AM对吸入细菌病原体的免疫反应,这是否与AMs移动有关?研究人员利用influenza A病毒感染小鼠,12天后小鼠开始恢复,肺部的PKH-AMs在肺泡间移动的能力显著下降,且AMs对铜绿假单胞菌和金黄色葡萄球菌的吞噬能力下降,中性粒细胞招募增加。RNA-seq分析显示,influenza A感染导致AMs中900多个基因上调,上调基因多与细胞因子产生、炎症反应、髓系白细胞激活等有关,且AM激活标志性分子MHC II、CD11b、CD103增加,即flu感染小鼠的AMs呈现炎性激活状态。检测其迁移特性,发现flu感染小鼠的AMs内在的迁移特性产生缺陷,使用IFNγ 中和抗体能部分恢复AM的迁移能力。即flu感染产生过多的IFNγ ,导致AM处于激活或炎性状态,损伤其迁移能力。
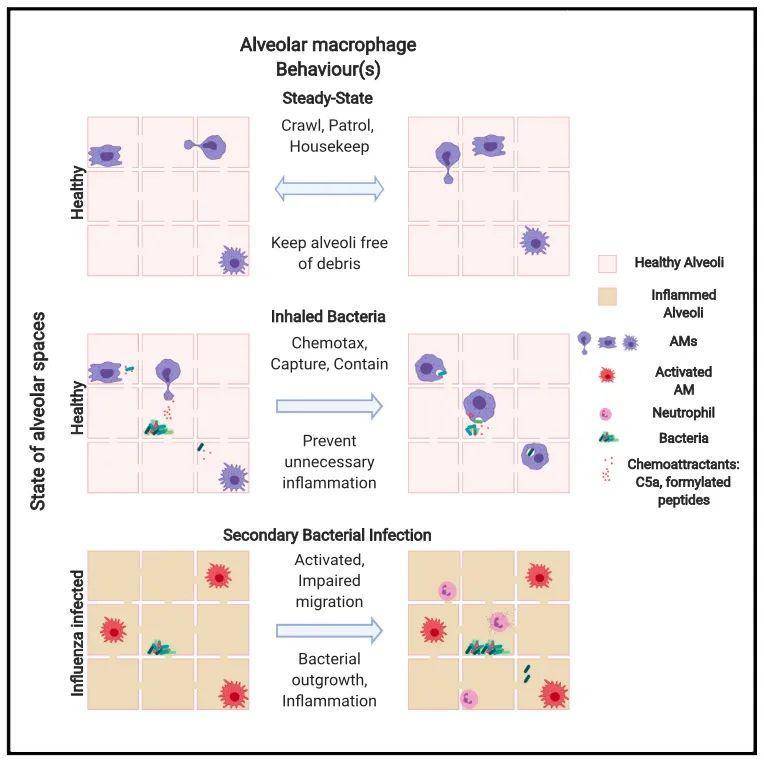
总的来说,研究揭示出肺泡巨噬细胞AMs在肺泡内和肺泡间移动,并且能指向性移动、吸入细菌并吞噬进行清除,而病毒感染会损伤AM的迁移导致继发性细菌感染。文章不仅开发出肺泡巨噬细胞的实时活体成像技术,而且揭示出AMs维持肺泡稳态的作用机制,为研究肺泡的免疫反应提供了新的角度。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652501188&idx=4&sn=b2845819c23ebee1e248a50fb6a1109a&chksm=84e26770b395ee661bbec2fb515597ee410f4ca1b4bcf2fb898d433fd5df2241b908e1c1a360#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

肿瘤感染:癌症患者该如何预防中性粒细胞减少症?

自然中不存在的蛋白质也能人造了!撼动材料医药界
Immunity报告生成中性粒细胞的稀有干细胞

吃太咸会降低免疫力!高盐饮食会抑制中性粒细胞抗击细菌性尿路感染的能力

Cell:单细胞测序揭示组织环境对中性粒细胞命运的共同决定作用
中性粒细胞计数(NEUT)

Cell :中性粒细胞驱动非常规T细胞介导抗肿瘤免疫
科学家首次观测到小鼠免疫系统识别入侵细菌全过程
抗中性粒细胞胞浆

Cell:中性粒细胞如何被募集至肝脏和肺脏?