科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-26
来源:iNature
由于HNH核酸酶结构域的位置远离切割位点,高分辨率的Cas9结构尚未显示出催化构象。 Nme1Cas9和Nme2Cas9是用于体内基因组编辑的紧凑型核酸酶。Nme1Cas9和Nme2Cas9都能切割很少或没有脱靶的哺乳动物基因组。但是,尚未报告Nme1Cas9和Nme2Cas9的完整结构。
2019年10月24日,中国科学院生物物理所王艳丽及马萨诸塞州大学医学院Erik J. Sontheimer共同通讯在Molecular Cell 在线发表题为“Structures of Neisseria meningitidis Cas9 Complexes in Catalytically Poised and Anti-CRISPR-Inhibited States”的研究论文,该研究报道了脑膜炎奈瑟氏球菌的两个Cas9同源物(Nme1Cas9和Nme2Cas9,II-C型)与sgRNA,dsDNA或抗CRISPR蛋白复合物的结构。 在Nme1Cas9的HNH催化状态下,可以看到活性位点保持在目标链的可裂解磷酸二酯键处,提供了活性构象的高分辨率视图。 HNH活性构象激活RuvC域。该研究结构解释了Nme1Cas9和Nme2Cas9如何读取不同的PAM序列以及AcrIIC3如何抑制Nme1Cas9活性。这些结构提供了对Cas9结构域重排,引导靶标参与,切割机制和抗CRISPR抑制的见解,从而有利于优化这些基因组编辑平台。
另外,2018年11月30日,中科院生物物理所王艳丽及章新政共同通讯在Cell 在线发表题为“Structure Studies of the CRISPR-Csm Complex Reveal Mechanism of Co-transcriptional Interference ”的研究论文,该论文报告了与crRNA复合的Csm结构以及同源或非同源靶RNA结合的Csm复合物的结构。总之,结构研究为crRNA介导的序列特异性RNA切割,RNA靶标依赖性非特异性DNA切割和cOA生成所需的机制过程提供了重要的见解(点击阅读)。

Cas9是II型CRISPR-Cas系统蛋白,是一种RNA可编程的DNA核酸内切酶,可通过RuvC和HNH结构域切割靶双链DNA(dsDNA)。 CRISPR-Cas9保护细菌免受入侵核酸的侵害,并提供了革命性的RNA指导的基因组编辑平台。 Cas9的活性需要CRISPR RNA(crRNA),反式激活的crRNA(tracrRNA)和DNA靶位点中的原间隔子相邻基序(PAM)序列的指导。可以将crRNA和tracrRNA融合到单向导RNA(sgRNA)中。
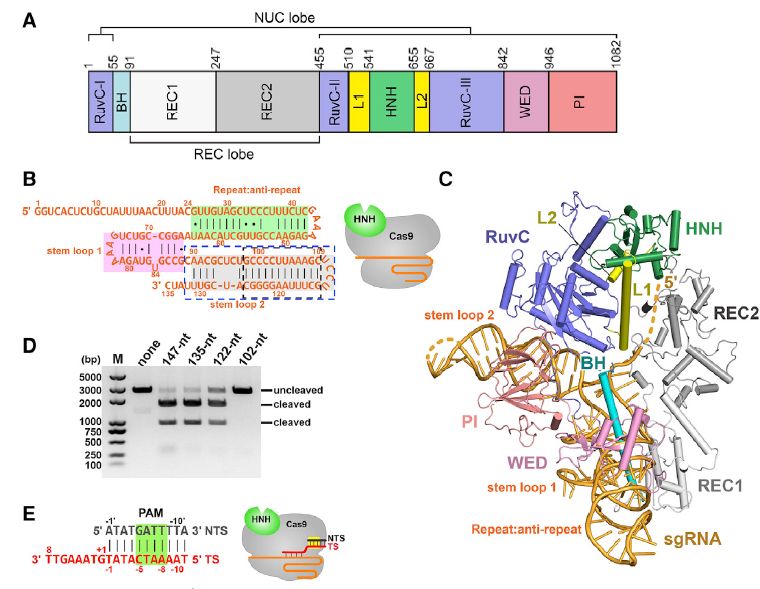
Nme1-Cas9-sgRNA和Nme1-Cas9-sgRNA-dsDNA复合物的整体结构
已经报道了具有不同结合形式的多个Cas9结构。然而,在可用的DNA结合的,预先切割的Cas9结构中,HNH活性位点与crRNA互补靶链(TS)的易分裂磷酸二酯相距较远,这表明HNH结构域在确定的结构之前经历了显著的构象变化切割TS。要了解TS裂解的机制,包括通过酶检测足以进行核酸酶激活的Guide-TS互补性,阐明处于DNA结合状态的Cas9复合物的催化能力至关重要。
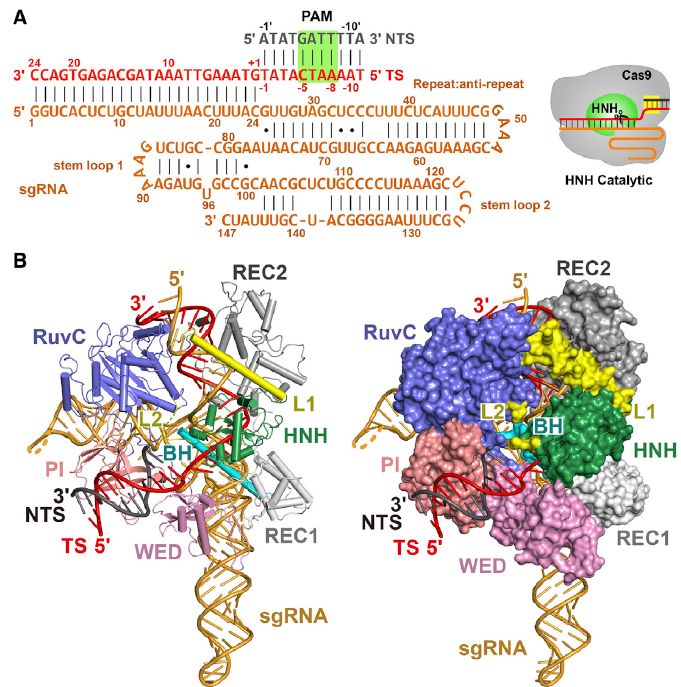
完全互补的Nme1Cas9 sgRNA dsDNA复合物在催化状态下的结构
来自脑膜炎奈瑟氏球菌的两个Cas9同源物(Nme1Cas9和Nme2Cas9,II-C型)已被开发为基因组编辑工具。它们有1,082个氨基酸,都比常用的II-A型直系同源SpyCas9小(1,368个氨基酸),使得Nme1Cas9或Nme2Cas9以及sgRNA可以与单个腺相关病毒(AAV)载体一起被递送。 Nme1Cas9和Nme2Cas9的PAM相互作用(PI)域高度差异(52%相同),即使蛋白质的其他部分> 98%相同。这种差异导致了不同的PAM特异性:Nme1Cas9的N4GAYW / N4GYTT / N4GTCT和Nme2Cas9的N4CC(PAM序列在非目标链[NTS]上为5'至3')。
两者也都可以被由流动遗传元件编码的抗CRISPR(Acr)蛋白抑制,这代表了控制Cas9的潜在强大的非开关策略。已经鉴定出五种抑制Nme1Cas9的抗CRISPR(AcrIIC1-AcrIIC5),除AcrIIC5Smu以外的所有抗体也均抑制Nme2Cas9。 Nme1Cas9和Nme2Cas9都能切割很少或没有脱靶的哺乳动物基因组。但是,尚未报告Nme1Cas9和Nme2Cas9的完整结构。
在这里,研究人员报告了Nme1Cas9和Nme2Cas9在5个不同功能构象中的结构:(1)Nme1Cas9-sgRNA,(2)Nme1Cas9与匹配的8 bp DNA结合,(3)Nme2Cas9-sgRNA在完全互补的DNA-结合但处于催化前状态,(4)Nme1Cas9-sgRNA处于完全互补的DNA结合和催化活化状态,(5)Nme1Cas9-sgRNA在TS切割后与完全互补的DNA结合。
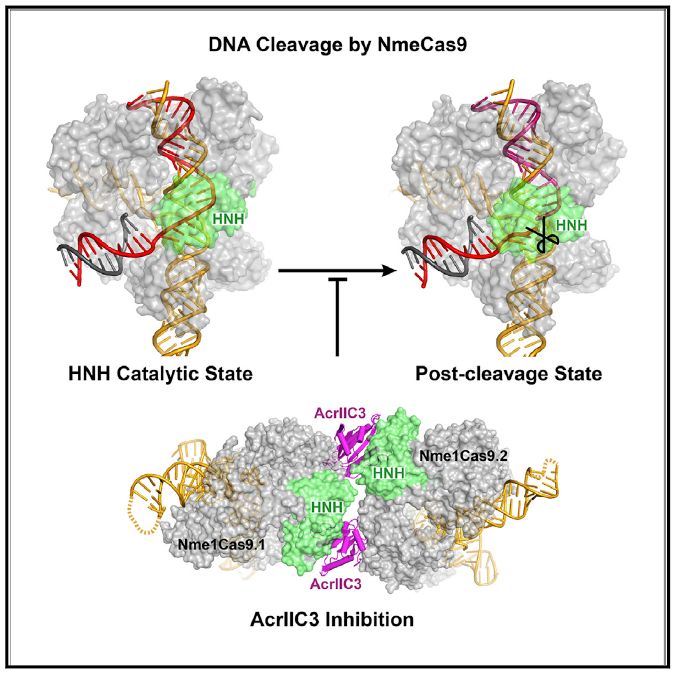
文章总结
此外,研究介绍了与Nme1Cas9-sgRNA结合的有效的nti-CRISPR结构(AcrIIC3Nme),处于DNA未结合和DNA结合状态。Nme1Cas9-sgRNA-dsDNA结构代表处于催化平衡状态的Cas9直系同源物的第一个高分辨率图,其中大量读出了TS-TS异源双链骨架和位于TS可分裂磷酸埃内的HNH结构域活性位点。这些研究将提供大量新的结构和机制见解,以应用于Cas9蛋白家族。
参考信息:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(19)30730-0
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247505195&idx=8&sn=273978e6a4b6718adbd4f7da8a7fc6d8&chksm=fce6a6f4cb912fe2f304a50baeca0229418c16d9060a64de4c366d564082cfa354d2076b0a48&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Developmental Cell | 打破技术壁垒!

Cell :噬菌体抗菌疗法开发

Cell Stem Cell | 骨骼肌干细胞如何应对环境污染物刺激?
mTORC2控制线粒体膜通透性,调节自噬流量并影响寿命长短

中文解读 | 基底膜在血脑屏障发育及维护屏障功能中的作用

Cell:科学家从下丘脑“揪出”体重控制基因—SEMA3A
Cell Stem Cell | 辛利组揭示微环境调控前列腺干细胞增殖的机制
研究透视:Cell综述-水凝胶
Cell Stem Cell :陈梦飞博士等揭示慢性炎症中嗅觉干细胞的角色转换
浙大34岁“歌神教授”:科研也是在创造艺术品


