科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-30
来源:上海同步光源
DUX4(Double Homeobox 4)属于双同源盒转录因子。同源盒基因在进化上是高度保守的。许多研究表明,同源盒基因对于发育的调控至关重要。同源结构域由约60个氨基酸残基组成,在N端,形成一段柔性loop和三个α-螺旋。N端loop和第三个α-螺旋参与DNA序列识别与特异结合。DUX4在成肌细胞中的异常表达激活了本该在人类胚胎中表达的基因和反转录转座子,从而引发细胞凋亡,并引起面肩肱型肌营养不良症(FSHD)。最近研究发现,DUX4参与人类胚胎基因组激活(embryonic genome activation,EGA)与胚胎植入前发育的转录调控。DUX4编码激活数百种内源基因(如ZSCAN4,KDM4E和PRAMEF家族基因)和逆转录病毒元件(MERVL / HERVL家族)的转录因子。2018年3月,上海交通大学医学院附属瑞金医院、上海市血液学研究所、国家医学基因组学重点实验室蒙国宇团队与陈竺、陈赛娟团队合作在血液学权威杂志Leukemia上在线发表了题为“Structural basis of DUX4/IGH-driven transactivation”的文章(Dong et al, Leukemia, March 2018)。在该篇报道中,蒙国宇团队在国际上首次解析了与DNA结合的DUX4-DNA的复合物结构,并在功能水平上验证了破坏DUX4与DNA的结合,将会显著影响DUX4对下游靶基因的激活,并进一步破坏DUX4/IGH这一癌蛋白对B细胞分化的抑制、增殖等效应。
10月12日,该团队在前期工作基础上继续深耕细作,在DUX4/IGH促进B淋巴细胞白血病(B-ALL)发生发展方面的研究又有新的突破,以“DUX4(HD2)-DNA(ERG) structure reveals new insight into DUX4-Responsive-Element”为题在Leukemia发表文章(Dong et al, Leukemia, September 2018)。文章报道了一种新的1.6?高分辨率的DUX4与其下游基因ERG的复合物结构,该复合物清楚地显示DUX4的Homebox(HD)结构域如何与来自B-ALL的内源性基因ERG位点结合。和之前结构信息相比较,该HD-ERG结构更真实的反映癌蛋白在体内如何结合其靶基因。结合高分辨率结构信息和白血病病人的ChIP-seq数据挖掘(图1),蒙国宇团队创新性地提出了一种DUX4/IGH识别DNA的新机制:即除了TAAT结合位点外,DUX4的HD结构域还可以与GAT重复序列结合。作者通过双荧光素酶报告基因实验中验证了该观点。同时,作者通过结构和功能比对,发现DUX4的HDs对比其他Homeobox蛋白家族有其独特性:DUX4是唯一可以同时识别GAT repeat,TAAT repeat和TGAT/TAAT chimeric repeat的homeobox。因此,该研究不但对DUX4-ALL型白血病有重要意义,也大大提高人们对Homebox 超级蛋白家族的理解。
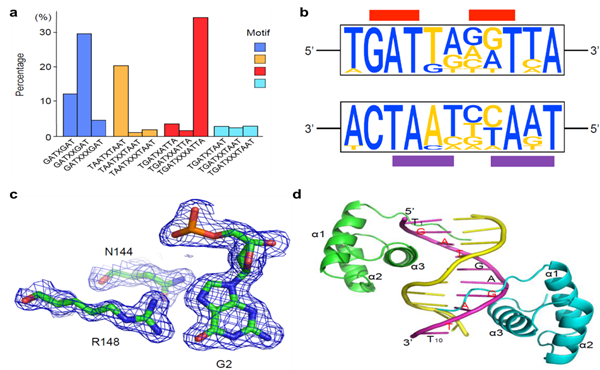
图1. DUX4-Responsive-Element的新发现。a) GAT repeat,TAAT repeat和TGAT/TAAT chimeric repeat在全部癌蛋白DUX4/IGH靶基因中的比例。b) DUX4/IGH的下游靶基因ERG的结合位点序列(蓝色)。c) DUX4-ERG结构的电子云密度图。d) DUX4-ERG结构。ERG DNA链标记了5'-T1GATGAGATT10-3'的正向链。 重复的GAT序列用红色显示。
特别一提的是,蒙国宇组最近在Leukemia上的连续研究都是来自临床203例B-ALL白血病病人的发现和延伸,有积极的临床转化意义。
蒙国宇教授为通讯作者,博士研究生董雪、张浩,硕士研究生程诺为共同第一作者。该项研究得到国家自然科学基金委、上海市高峰高原计划、上海市东方学者等项目的支持,并得到上海同步辐射光源晶体学线站(BL17U1/18U1/19U1)的工作人员在数据收集中提供的帮助。
文章链接:https://www.nature.com/articles/s41375-018-0273-z

同轴TKD—纳米尺度晶体学表征的最优解决方案

周末大家谈——怀念402小院
上海光源生物大分子晶体学线站用户在硅藻特有捕光天线蛋白复合体结构研究取得重大突破
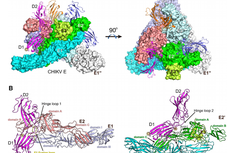
上海光源晶体学线站用户破解基孔肯雅病毒入侵机制
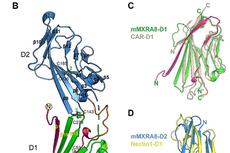
上海光源晶体学线站用户破解基孔肯雅病毒入侵机制
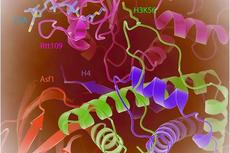
上海光源晶体学线站用户揭示组蛋白乙酰转移酶活性调节的新机制
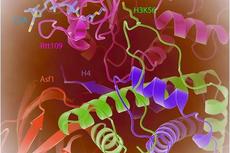
上海光源晶体学线站用户揭示组蛋白乙酰转移酶活性调节的新机制
Nature:全球首次,开拓新技术,毛河光院士团队获得分子氢第四相晶体学信息




请支持武汉光源蛋白质晶体学与生物医药应用线站建设!用户意见征询
相变晶体学