科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-18
来源:BioArt
尽管肿瘤转移通常被认为是单个细胞介导的过程,但是在肿瘤侵袭的前线、系统循环以及远处器官定植中都能观察到肿瘤多细胞簇。在临床中,循环肿瘤多细胞簇与多种类型肿瘤预后较差有关。在不同的小鼠模型中,多细胞簇可引起50-97%的肿瘤转移。与单细胞转移相比,多细胞簇扩散以及向外生长的驱动分子机制的研究还远远不够。
多细胞簇显著增强了肿瘤的转移潜力,并具有增强的干细胞样特征,逃避天然杀伤细胞靶向作用,以及对放射疗法和代谢应激的抵抗性。在多项研究中发现,破坏细胞粘附基因能够降低细胞簇的形成和细胞转移。另有研究报道,多细胞性和细胞间粘附会在组织形态发生过程中诱导出“类社会样”的协同信号转导(cooperative social-like signaling)。也有研究已经提出,肿瘤细胞之间的协同相互作用可以促进转移。因此这也暗示肿瘤细胞的聚集可能引起不同于单个细胞的复杂信号转导机制。但是细胞簇如何诱导这些特性的产生还不清楚。
近日,美国西雅图Fred Hutchinson肿瘤医学研究中心的Kevin J. Cheung团队在Cell上发表题为Regulation of Collective Metastasis by Nanolumenal Signaling的研究。该研究发现肿瘤细胞簇中细胞间部位形成腔结构,调控肿瘤转移和转移灶生长。

本研究作者利用已经被报道过存在细胞簇转移的MMTV-PyMT模型。MMTV-PyMT肿瘤细胞表面带Tomato荧光标记,肿瘤细胞类器官被分解成单个细胞后6小时后会自发聚集成团。于是作者将细胞分为四组:细胞聚集0小时、6小时或者24小时,24小时聚集组再次解离成单个细胞。之后同等数量的细胞接种NSG小鼠三周,检测肺转移灶数量,聚集24小时的细胞组转移灶最多。接下来作者以此为模型研究细胞簇转移定植的机制。
作者分别对四组细胞进行转录组分析,相对于0小时组,聚集6小时组细胞高表达EGFR的低亲和力配体epigen和amphiregulin,其中epigen上升最明显。这些配体与延长的EGFR信号有关,并会产生不同的效应。配体非依赖的EGFR激活分子Plaur也上升明显,因此作者假设生长因子产生和EGFR激活可以支持肿瘤细胞簇转移灶定植。作者利用慢病毒RNAi技术分别降低EGFR、Epigen、 amphiregulin和 Plaur的表达。Epgn-kd细胞降低了94%的肺部肿瘤转移性生长。分析对照组和Epgn-kd细胞的转录组发现,Epigen可以将细胞从促转移转换为促生长状态。免疫荧光染色发现Epigen主要定位在细胞簇中的细胞间区域,并不会向远处扩散。通过将对照组和Epgn-kd组细胞混合等实验,作者发现Epigen以非细胞自主的(Non-cell-Autonomously)方式在细胞簇中发挥作用,效应存在浓度依赖性。
用透射电镜作者观察到在细胞簇中细胞之间并不是完全紧密贴合的,存在空腔结构,空腔由细胞间连接界定,并列排有微绒毛样的突起。作者将细胞间的腔隙称为“nanolumina(纳米腔)”。Epigen的敲除并不会影响nanolumina的形成。Epigen可以在nanolumina结构中扩散。如若限制细胞连接的通透性可以增加细胞簇内Epigen的浓度。利用免疫电子显微镜,作者发现pEGFR 和 HER2在nanolumina腔周围分布丰度较高,因此作者推测在nanolumina中形成了一个epigen-EGFR信号富集区。
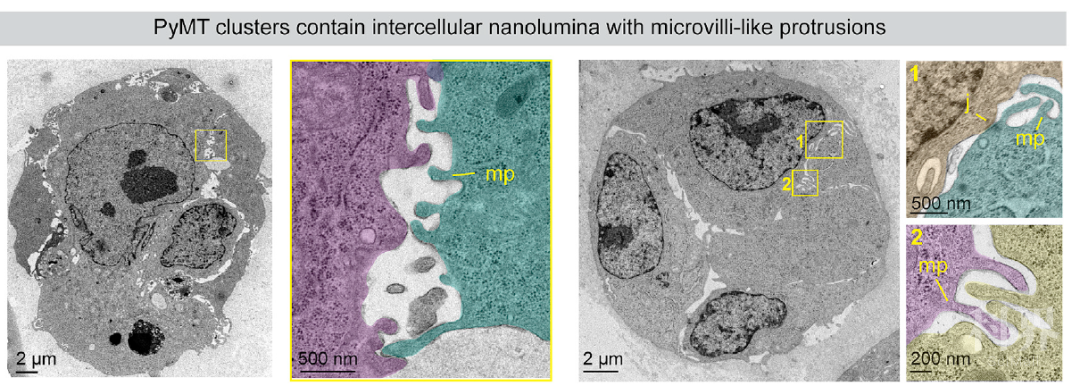
电镜下肿瘤细胞间的Nanolumina结构
以上实验都是离体实验,作者将细胞移植到NSG小鼠脂肪垫中进行体内实验。作者发现,epigen 、pEGFR和HER2在原位肿瘤和远端定植细胞以及局部非突起的细胞簇都有高表达,在局部散布的单个细胞中、突起的细胞簇以及非肿瘤组织中表达较低。
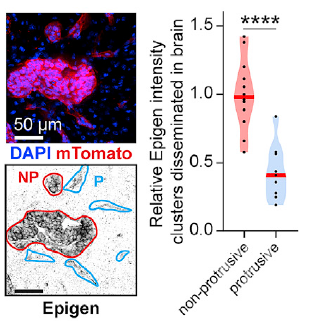
突起部位和非突起部位epigen表达对比
作者在MMTV-PyMT原位肿瘤中观察到nanolumina的结构。对比各个部位细胞簇的通透性,作者发现到突出的细胞簇通透性明显大于非突出的细胞簇,原位肿瘤和转移灶的通透性都较低。这也表明,nanolumina通透性增加以及epigen积累发生在转移灶生长的阶段。利用对照组细胞和Epgn-kd细胞,作者在体内实验也证明了nanolumina的删除抑制了转移灶生长的过程。
接下来作者检测了这个发现在人类乳腺癌中的普遍性情况。作者收集了乳腺癌病人的肿瘤细胞簇,在ER+/PR+/ HER2-病人细胞簇中发现了nanolumina结构以及细胞间的nanolumina和pEGFR分布。在乳腺癌细胞系中检测,作者发现不同的细胞系中epigen表达情况各不相同,nanolumina和epigen富集在侵袭转移性高的细胞系中。其中细胞系HCC70是epigen表达最高的细胞系,作者用这个细胞系验证了在人的乳腺癌模型中存在与小鼠相同的nanolumina 结构以及epigen依赖的促进转移灶生长的现象。
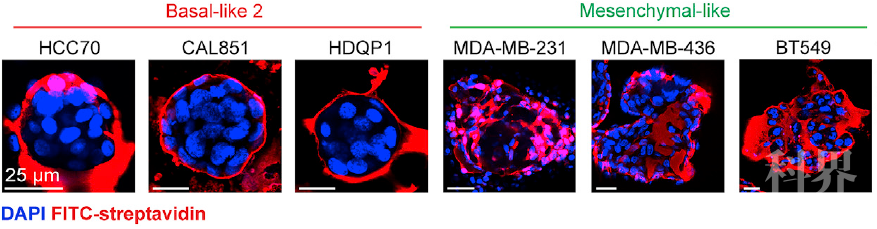
各细胞系细胞簇通透性对比
由于IFN-γ可以增强细胞旁扩散能力,提高上皮细胞通透性,促进免疫反应。因此作者用IFN-γ处理细胞簇发现HCC70细胞簇通透性增加,而epigen表达低的细胞系对IFN-γ则不敏感。IFN-γ预处理的HCC70细胞打进NSG小鼠尾静脉,形成的转移灶数量少,体积小。
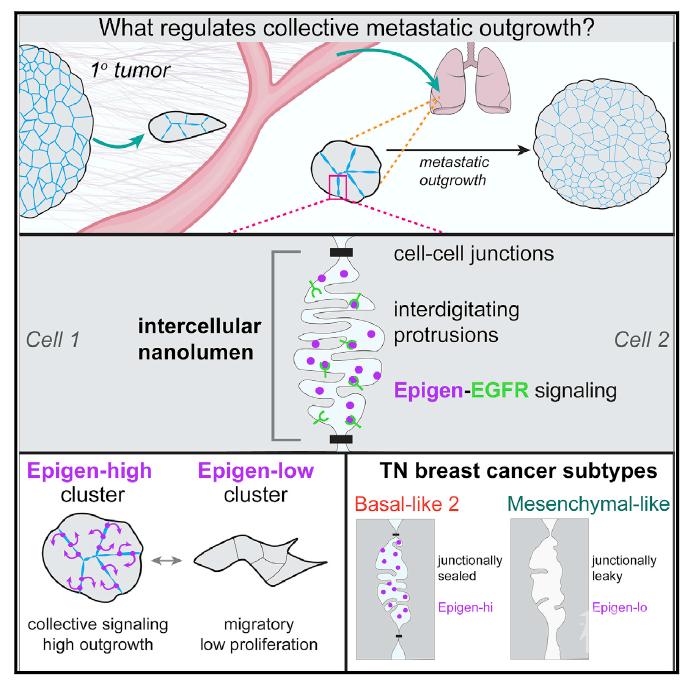
尽管IFN-γ具有多效性,但是本研究表明,打开nanolumina结构,会损害肿瘤细胞簇转移性生长过程。有研究发现在正常的乳腺组织中也存在类似的结构,但功能未知。关于在正常组织以及肿瘤中nanolumina的信号转导机制还有待研究,以开发出靶向nanolumina的抑制细胞簇转移的治疗方法。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652503941&idx=5&sn=7585ed72b0d46f1129886a06b46ad5e9&chksm=84e26c31b395e5272a108e16f77126e87d73c4c4cdbdf6bed0956f38fac076d5e01eedee4a34#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

中年人要担心的不只是油腻,45岁起就该开始结直肠癌筛查
中国科学家首先创新艾滋病北平顶猴感染模型

血流影响肿瘤细胞转移
陈佩文博士等揭示双重调控胶质瘤干细胞及肿瘤免疫的分子机制

发光纳米颗粒可以更快更精准地检测癌症

美研究说高剂量手机辐射可致大鼠心脏肿瘤

肿瘤干细胞研究取得进展
胸腔积液肿瘤细胞学检查
Nature:科学家揭示调节免疫细胞抗肿瘤活性的新型分子机制
“蛋结构”材料能有效杀伤肿瘤细胞