科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-30
来源:Nature自然科研

《自然-通讯》本周发表的一篇论文Cryo-EM structure and polymorphism of Aβ amyloid fibrils purified from Alzheimer’s brain tissue报道了从阿尔茨海默病和脑淀粉样血管病患者脑组织分离的β淀粉样蛋白原纤维的结构。研究结果为理解阿尔茨海默病的结构基础提供了新认识,或有助于相关药物开发。
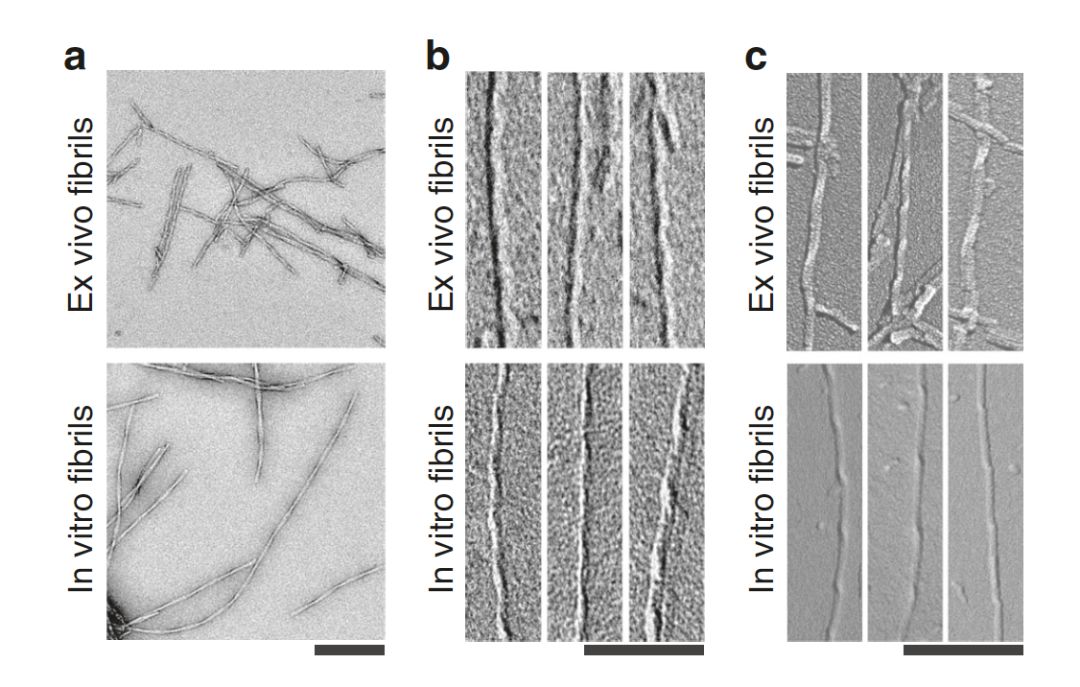
脑源性和实验室制备的β淀粉样蛋白原纤维的不同结构。| 来源:Kollmer et al.
阿尔茨海默病是一种进行性的神经退行性疾病,它的一大特征是β淀粉样蛋白原纤维在斑块和血管壁的沉积。虽然实验室制备的β淀粉样蛋白原纤维在结构上已经得到了很好的表征,但这些纤维在大脑中的结构一直知之甚少。
德国乌尔姆大学Marcus Fändrich和同事在三位阿尔茨海默病患者死后从他们大脑组织中纯化了β淀粉样蛋白原纤维,并用冷冻电子显微镜分析了其结构。作者在所有三名患者的样本中都发现了三种各不相同但结构相关的β淀粉样蛋白原纤维形态,并确定了其中一种形态的分子结构。出乎意料的是,脑源性原纤维的结构与实验室制备的β淀粉样蛋白原纤维的结构差异显著。比如,脑源性β淀粉样蛋白原纤维是右旋折叠,它们的肽折叠方式也与此前分析的原纤维折叠方式非常不同。
该结构突出了表征患者源淀粉样原纤维的重要性。此外,该研究还有助于理解阿尔茨海默病导致的突变对β淀粉样蛋白的影响,或有助于开发防止这类原纤维形成的药物。
© nature
Ncomms|doi:10.1038/s41467-019-12683-8
点击“阅读原文”阅读论文
Cryo-EM structure and polymorphism of Aβ amyloid fibrils purified from Alzheimer’s brain tissue
相关文章
运动诱发激素或能防止阿尔茨海默病相关的记忆损失|《自然-医学》
《自然》新研究发现不同阿尔茨海默的淀粉样蛋白沉积结构不同
版权声明:
本文由施普林格·自然上海办公室负责翻译。中文内容仅供参考,一切内容以英文原版为准。欢迎转发至朋友圈,如需转载,请邮件China@nature.com。未经授权的翻译是侵权行为,版权方将保留追究法律责任的权利。
© 2019 Springer Nature Limited. All Rights Reserved

来源:Nature-Research Nature自然科研
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwNTAyMDY0MQ==&mid=2652564695&idx=4&sn=d94da15e19a5349ad197fd8c2ff47462&chksm=80cd4259b7bacb4f7e3e07f9e25d46150fef6ebbabc337a64dcdc5c60c8c9ca5ef1ad542275e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

比尔盖茨投1亿美元研究老年痴呆症
爱吃粉条易患老年痴呆?
【健康】关于老年痴呆,这些你该了解
脑细胞酸碱失衡或致老年痴呆
输血或传播老年痴呆
爱吃粉条易患老年痴呆?

寻找“老年痴呆”鼠
Alzheimer D. :老年痴呆症与淀粉样蛋白在脑组织中的沉积有关

治疗老年痴呆,神经免疫学研究带来希望

老年痴呆有办法了,为家人留着!