科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-27
来源:中国生物物理学会
中科院青岛能源所代谢物组学研究组冯银刚研究员带领的研究团队在能源微生物的一对相互作用蛋白质模块中发现了一种独特的pH依赖的双结合位点切换现象,并阐明了其化学和结构机制,相关成果近日发表于国际高影响刊物Science Advances。该研究不仅揭示了生物体系复杂精巧的调控机制,同时也为pH依赖的蛋白质器件和生物材料开发提供了新的素材,在合成生物学和生物技术应用中具有重要价值。
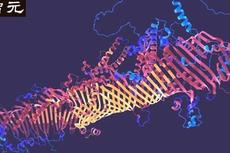
pH是几乎所有在水溶液中进行的化学反应的重要因素,在几乎所有的生命过程中具有重要的作用。生物体中有许多pH依赖的蛋白质功能开关,不仅可调控细胞的生理和生化过程,而且可作为生物技术开发中的关键感应器件和功能开关。目前已知的pH依赖的蛋白质构象变化都是通过感应pH变化实现“打开-关闭”式的开关切换控制,发现新型的pH依赖的蛋白质互作方式具有重要的科学应用价值。中科院青岛能源所代谢物组学研究组长期以来以一种高效降解木质纤维素的多酶复合体“纤维小体”为对象开展研究,并在研究一种产溶剂梭菌——丙酮丁醇梭菌——的纤维小体时,发现了一种全新的pH依赖的蛋白质相互作用变化方式。研究人员通过核磁共振技术发现该细菌中的一对纤维小体组装模块——粘连模块和对接模块——在低pH条件下会选择性结合于一个位点,而在高pH条件下选择性结合于另一个位点,从而形成了在不同pH条件下两个相互作用位点之间的切换(图1)。随后,研究人员利用核磁共振、X射线晶体学、微量热、分子动力学模拟等多种生物物理技术,揭示了这两个蛋白模块相互作用在pH依赖性方面的化学和结构机制:对接模块上两个结合位点的多对不对称残基,以及粘连模块上结合位点处的一段富含负电的柔性区残基的pKa漂移共同造成了这对蛋白模块相互作用的pH依赖的位点切换现象。这种精巧的pH依赖的蛋白质互作模式不同于其他已知的pH依赖性蛋白质互作方式,不仅揭示了生命体中可能存在的复杂分子作用机制,而且为生物材料开发、蛋白质感应器件设计、合成生物学元件设计等多种生物技术应用提供了崭新的素材和方案。
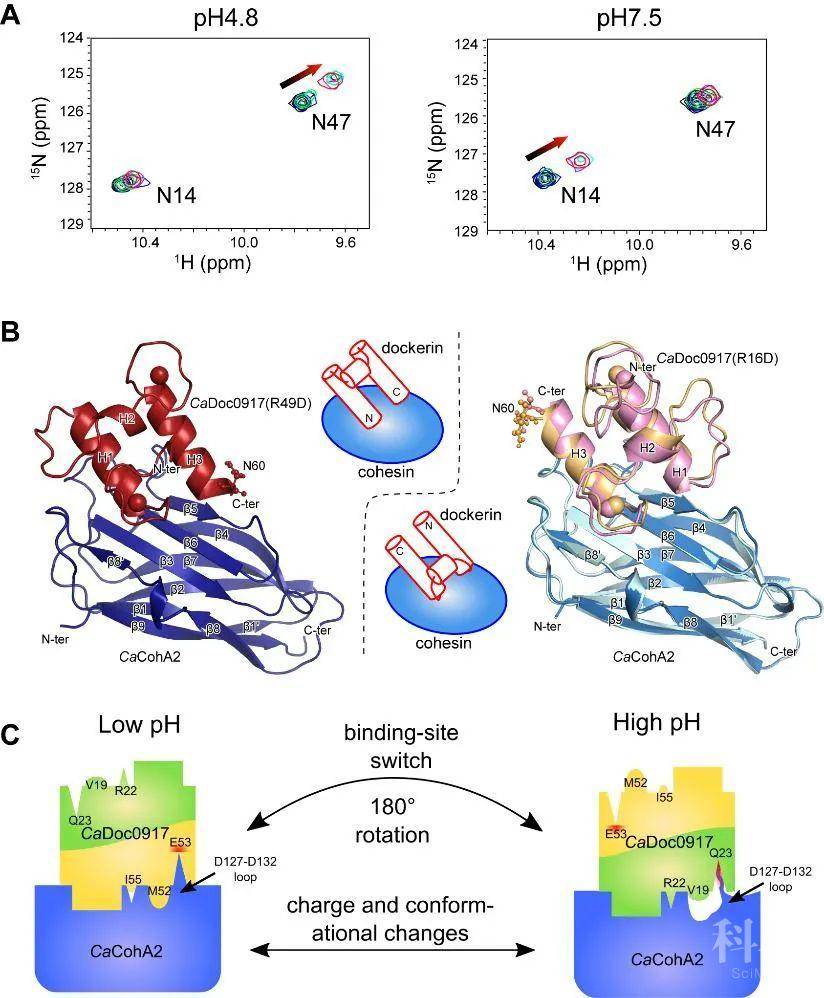
图1. pH依赖的蛋白质相互作用位点切换。A. 不同pH条件下通过核磁共振观测到的不同的相互作用位点。B. 两种结合方式的复合物晶体结构。C. pH依赖的结合位点切换机制的卡通模型。该模型中蓝色为粘连模块,黄色/绿色为一个对接模块上的两个部分对称的结合位点。
中科院青岛能源所代谢物组学研究组长期致力于木质纤维素降解利用和生物质燃料开发,在高效降解木质纤维素的分子机器“纤维小体”研究中取得了多项重要的研究成果,在高温厌氧菌的遗传改造、代谢工程和合成生物学开发方面,形成了独具特色的研究方向和国际领先的技术优势。该论文所报道的研究成果是青岛能源所代谢物组学研究组长期坚持在木质纤维素降解利用和“纤维小体”研究中取得的重要成果。青岛能源所代谢物组学研究组博士生姚形哲、助理研究员陈超、蛋白质设计研究组副研究员王业飞是本论文的共同第一作者,代谢物组学研究组冯银刚研究员为本论文的通讯作者。该工作得到了国家自然科学基金委、中科院以及以色列科学基金会的资助。
原文链接:https://doi.org/10.1126/sciadv.abd7182
由中国生物物理学会主办的
“第十八次中国暨国际生物物理大会”
将于2020年11月15-18日
在广东省广州市召开

欢迎全国各研究机构、高等院校
和企业的科技工作者参加
中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
微信号:BSC-1979

来源:BSC-1979 中国生物物理学会
原文链接:http://mp.weixin.qq.com/s?__biz=MzA4NjE1NTQ5Mg==&mid=2649503682&idx=2&sn=ba7fa661a951ee0c7d6fb123e6ffbbca&chksm=87d59e49b0a2175ff73571a32e6cbee147979c3d15c42aa27cb0c32a8a414d046777f8c30a66&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Angew. Chem.:蛋白质异质索烃的生物合成及晶体结构解析

关于蛋白质合成的相关研究
Nature子刊:利用蛋白质快速光化学氧化与质谱连用解析蛋白质高级结构

用突变基因,解码蛋白质结构
中国毒理学会2017年活动计划
从预测进化 AI能“构想”新蛋白质结构
AlphaFold 2再发350000种蛋白质结构预测结果,解锁98.5%人类蛋白质组!

套索蛋白质的理性设计、生物合成与拓扑结构转换
“2016海峡两岸植物生物学青年科学家学术论坛” 在中国计量大学顺利举行

人工智能预测蛋白质结构(新知)