科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-30
来源:BioArt
当前CRISPR-Cas9技术在基因编辑领域有着无与伦比的地位,其在临床治疗中的应用前景也广受期待。各类临床应用中,人类生殖细胞系中的基因编辑一直是学术界和舆论的焦点:一方面,其在遗传性疾病的根治和疾病预防等方面独具优势;另一方面,其存在的安全风险和伦理道德问题也引来诸多争议,需要更深入的研究和探讨以评估其前景。
就可行性而言,早在2015年,中山大学黄军就团队便已成功将CRISPR-Cas9技术用于人类胚胎的基因编辑【1】。2017年,美国知名科学家Shoukhrat Mitalipov在Nature 发文,称可以利用CRISPR-Cas9技术对人类胚胎中的致病遗传变异进行修复。不过其修复机制却出人意料:父源生殖细胞中的致病遗传变异并非被外源模板修复,而是以卵细胞的同源染色体为模板进行修复(详见BioArt介绍:【黄军就点评】科学狂人Nature发表编辑人类胚胎成果丨BioArt特别关注)【2】。
这一结果引来一片质疑声:包括哥伦比亚大学干细胞研究者Dieter Egli、纪念斯隆—凯瑟琳癌症中心发育生物学家Maria Jasin 及澳大利亚阿德莱德大学研究者Paul Thomas在内的多名学者撰文称,精子和卵子的基因组在发育早期距离较远,难以发生同源染色体间的重组修复,Nature一文的结果很可能是致病遗传变异周围基因组的大片段缺失所致(详见BioArt介绍:热门成果引争议丨人类胚胎基因编辑引发的担忧与回应)【3-4】。此外,今年发表于bioRxiv的文章指出,人胚胎中利用CRISPR-Cas9技术进行基因编辑常会导致染色体大片段缺失,这让人们对Nature一文的结果有更多疑虑,也更为担心CRISPR技术的安全风险【5】。
2020年10月29日,来自哥伦比亚大学儿科和Naomi Berrie糖尿病中心的Dieter Egli实验室在Cell 杂志上发表题为Allele-Specific Chromosome Removal after Cas9 Cleavage in Human Embryos的论文。文章对CRISPR-Cas9技术修复人类胚胎中致病遗传变异的各种可能后果进行了系统梳理。研究指出,在人类胚胎中,CRISPR-Cas9技术难以诱导内源性的同源重组修复实现致病变异的修正。实际上,除通过非同源性末端接合(NHEJ)和微同源性末端接合(MMEJ)进行修复外,Cas9诱导出的众多DNA双链断裂(DSBs)无法修复,这最终导致染色体大片段乃至整体的缺失。这一研究对Nature一文持批判态度,更指出CRISPR技术编辑人类胚胎的安全性仍被低估。

为全面梳理CRISPR-Cas9技术在人类胚胎中编辑致病遗传变异位点的各种可能后果,研究者选取EYS基因含单碱基G缺失突变的视网膜色素变性男性患者作为精子供体开展相关实验。研究者设计出针对该突变的高特异性向导RNA(gRNA),可精准靶向父源突变型EYS基因拷贝。此外,父源EYS基因拷贝附近有多个SNPs位点可用于评估同源染色体间重组修复发生的可能性。
为保证研究的全面性,研究者采取两种策略探究CRISPR-Cas9技术编辑人类胚胎中致病遗传变异的各种可能后果:一是通过卵胞浆内单精子注射技术(ICSI),将突变型精子与Cas9-gRNA的核糖核酸蛋白(RNP)复合物共同注射入卵细胞中;二则是在受精后的二细胞期注射Cas9-gRNA的RNP复合物。这两种策略有助于分析胚胎不同发育时段对基因编辑效果的影响。研究发现,无论何种策略,都会导致部分胚胎的细胞中只能检测到母源的野生型EYS拷贝。这一现象有三种可能的解释:父源突变型EYS拷贝未能修复,修复后的父源突变型EYS拷贝无法检测或同源染色体间的重组修复。而第三种解释正是2017年Nature一文的观点。
研究者首先利用孤雄胚胎(只含父源基因组)开展基因编辑实验,以分析无同源染色体存在的条件下基因编辑的可能后果。结果显示,孤雄胚胎经基因编辑后也存在EYS拷贝无法检测的现象。随后,为验证母源基因组作为修复模板的可能性,研究者对ICSI策略获得的胚胎进行全方位分析,结果发现,胚胎中父源突变型EYS拷贝的缺失不是技术原因导致的无法检测,也并非源自同源染色体间的重组修复,而很可能是DSBs未能及时修复导致的染色体大段缺失甚至整体缺失。与此相似的是,第二种策略,即在二细胞期注射Cas9-gRNA复合物获得的胚胎中,父源突变型EYS拷贝的缺失也主要是源自有丝分裂异常导致的染色体大段缺失甚至整体缺失。虽然策略二的条件下,胚胎中存在同源染色体间重组修复的可能性,但其发生概率很低(约7%)。(图1)
文章的最后,研究者还对人类胚胎中CRISPR-Cas9技术的脱靶风险进行了细致的评估,结果显示,除引发小片段的插入缺失突变外,CRISPR-Cas9系统在部分脱靶位点处还会导致染色体的部分缺失。(图1)
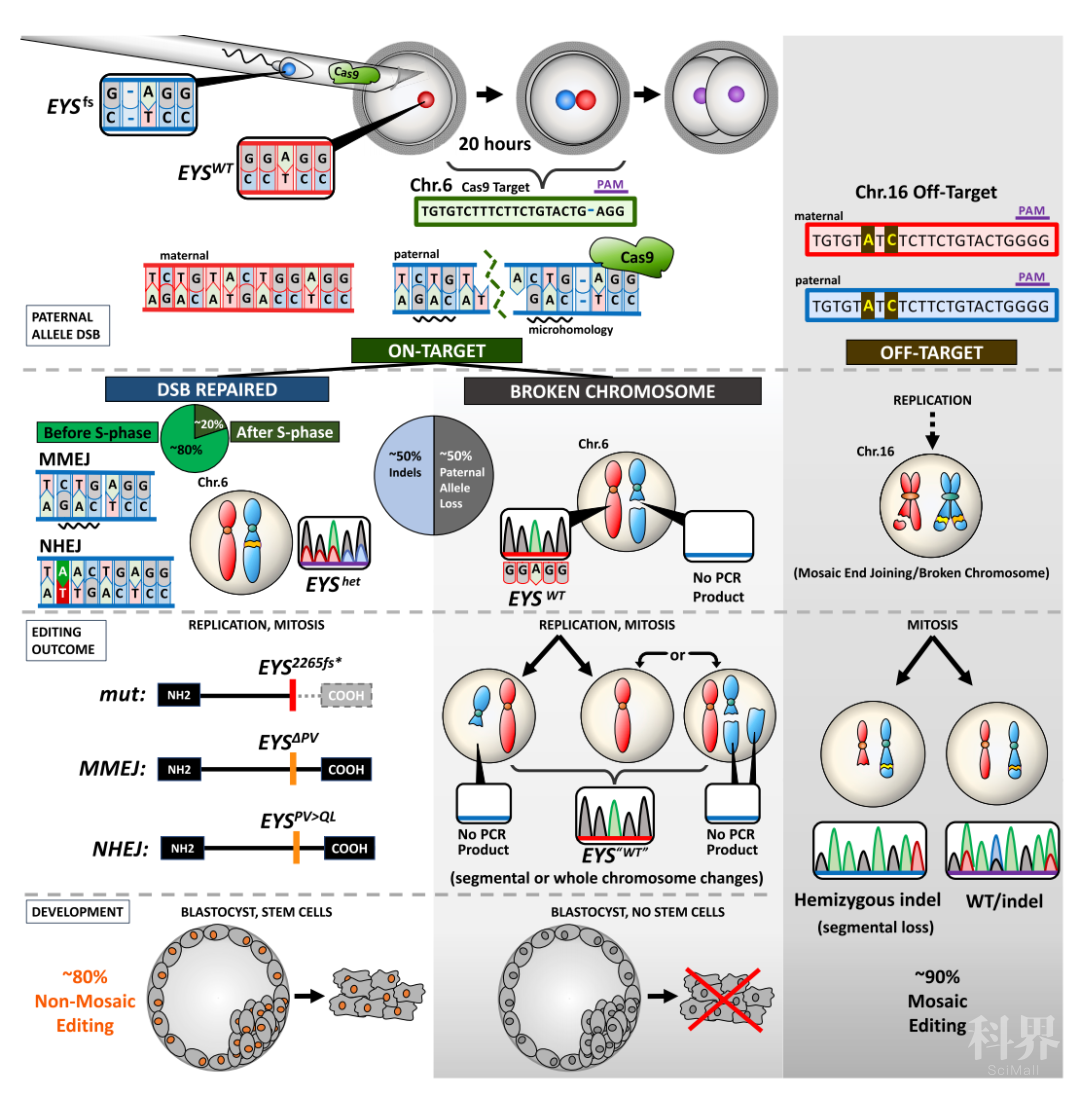
图1 人类胚胎中CRISPR-Cas9技术进行基因编辑后的各种可能后果
本研究通过一系列实验证实,在人类胚胎中利用CRISPR-Cas9技术开展基因编辑存在高风险:其风险并不局限于Cas9在脱靶位点引发小片段的插入缺失突变;更在于其对染色体结构乃至基因组整倍性的破坏。此外,本研究对2017年Nature的结果持批判态度,指出其结果很可能是携致病突变的染色体丢失而导致的假阳性。总体而言,目前人们对CRISPR-Cas9系统的编辑特点和安全风险仍然认识不足,因此仍需要开展更多研究以保证其在未来临床应用中的安全性。
参考文献
1. Liang, P., Xu, Y., Zhang, X., Ding, C., Huang, R., Zhang, Z., Lv, J., Xie, X., Chen, Y., Li, Y., et al. (2015). CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell 6, 363-372.
2. Ma, H., Marti-Gutierrez, N., Park, S.W., Wu, J., Lee, Y., Suzuki, K., Koski, A., Ji, D., Hayama, T., Ahmed, R., et al. (2017). Correction of a pathogenic gene mutation in human embryos. Nature 548, 413–419
3. Adikusuma, F., Piltz, S., Corbett, M.A., Turvey, M., McColl, S.R., Helbig, K.J., Beard, M.R., Hughes, J., Pomerantz, R.T., and Thomas, P.Q. (2018). Large deletions induced by Cas9 cleavage. Nature 560, E8–E9
4. Egli, D., Zuccaro, M.V., Kosicki, M., Church, G.M., Bradley, A., and Jasin, M. (2018). Inter-homologue repair in fertilized human eggs? Nature 560, E5–E7
5. Alanis-Lobato, G., Zohren, J., Mccarthy, A., Fogarty, N.M.E., Kubikova, N., Hardman, E., Greco, M., Wells, D., Turner, J.M.A., and Niakan, K.K. (2020). Frequent loss-of-heterozygosity in CRISPR-Cas9-edited early human embryos. bioRxiv. https://doi.org/10.1101/2020.06.05.135913.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652505593&idx=1&sn=21dacdd3e10e0a926d6969a8286b49e0&chksm=84e1964db3961f5bdabfc58187f13b3717c218ab25b5eac9e00d6b1318606b77a298aaeac93b#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
基因编辑 CRISPR Nature cell 人类染色体 crispr-cas9 染色体结构变异 拷贝
CRISPR-Cas9基因编辑技术可用于治疗地中海型贫血症

中国科学家率先培育出带有基因剪刀的工具猪
研究发现CRISPR-Cas9基因编辑系统在灵长类中不会导致明显的脱靶效应

Cell | 高通量筛选抑制CRISPR-Cas9的小分子药物

Science:科学家发现新型基因编辑工具,体积是CRISPR-Cas9的一半!

让Crispr-Cas9基因编辑技术与类器官培养研究如虎添翼的利器
超越CRISPR-Cas9的“DNA碎纸机”

蒲慕明院士:建设世界一流期刊关系学术创新的发言权
NEJM:CRISPR-Cas9体内基因编辑方法治疗转甲状腺素蛋白淀粉样变性

中国科学家培育出基因编辑瘦肉猪:脂肪少24%