科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-31
来源:iNature
线粒体的命运如何被决定是一个基本的生物学问题。「劣质」的线粒体抑或融合入细胞内的线粒体网络之中被重新「洗牌」,抑或被选择性的清除,后者被称为线粒体自噬(mitochondrial autophagy; mitophagy)。
线粒体自噬是一种特化的细胞器选择性自噬过程,对线粒体的质量、数量控制起管家作用。线粒体自噬失调与一系列退行性疾病、癌症、糖尿病、肥胖、心脏病、炎症反应、抗病毒反应等都有关联。已有明确报道,线粒体自噬基因的突变与帕金森症、肌萎缩性侧索硬化症有关。
目前关于线粒体自噬的研究大多集中在激活的正向调控机制上,包括 PTEN 诱导激酶 1(PTEN-induced kinase 1,PINK1) /E3 泛素连接酶 Parkin 途径、类 NIP3 蛋白 X (NIP3-like protein X,Nix) 途径、携带 FUN14 结构域蛋白 1 (FUN14 domain-containing protein 1,UNDC1) 途径等 [1-4]。除了线粒体脱泛素化酶 USPs 和 PTEN-L 磷酸酶对 Parkin 介导的自噬的负调控研究外 [5,6],对线粒体自噬的负调控知之甚少。因此,线粒体自噬启动的基本调控机制仍有待探索。
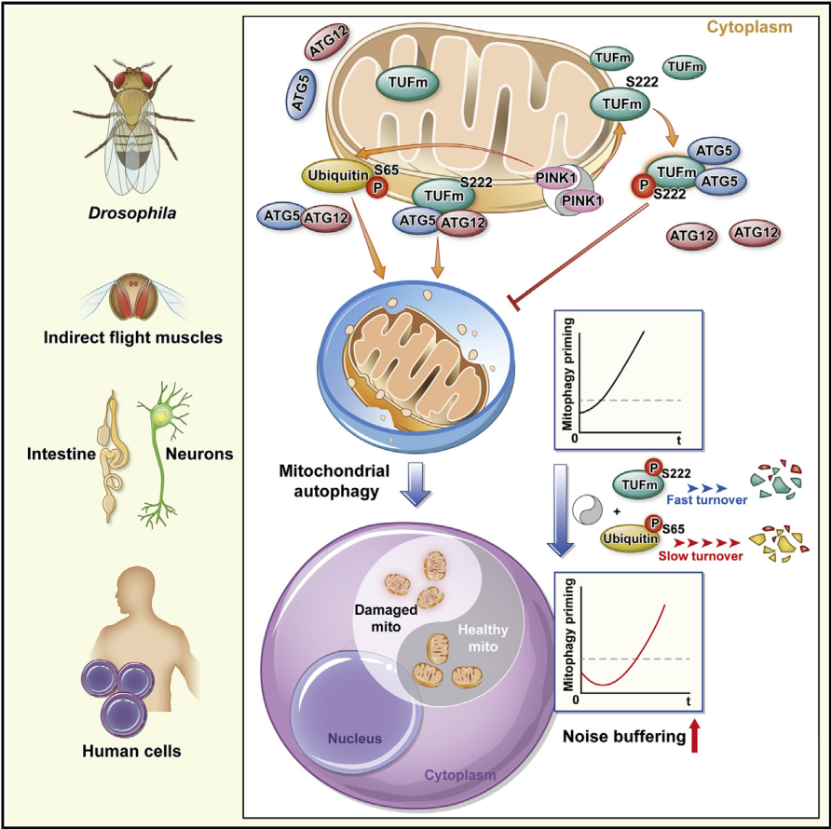
2020 年 10 月 27 日,福州大学生命科学研究所的杨宇丰课题组、东部战区疾控中心李越希教授等多家合作研究单位在 Molecular Cell 杂志在线发表了题为 Paradoxical Mitophagy Regulation by PINK1 and TUFm 的研究论文 [7],作者通过生物化学、遗传学、细胞生物学、活体疾病模型以及数学建模等多种研究方法,揭示了一种由 PINK1 及其新激酶底物 TUFm 所介导的线粒体自噬调控新途径。

TUFm 传统上被认为是一个核编码的线粒体蛋白翻译延伸因子。有趣的是,该研究发现 PINK1 通过磷酸化 TUFm 的一个保守丝氨酸位点,可将 TUFm 的促线粒体自噬功能转变为抑制功能。
因此,与目前比较公认的 PINK1 激活线粒体自噬的功能一起,PINK1/TUFm 组合构成了调控线粒体自噬的一把双刃剑:这种具有双向调控能力的 PINK1/TUFm 信号可能确保更严格与更精细的线粒体自噬调控,防止线粒体被过度清除,信号调控环路面对信号噪音的抗干扰能力也更稳健,让我们可以从中品味生物微观调控之精致美妙。
作者首先通过免疫共沉淀 - 质谱鉴定了线粒体翻译延伸因子 TUFm 作为 PINK1 的互作蛋白,并确认了它们的内外源物理相互作用。随后利用果蝇遗传学实验,作者证实了 TUFm 和 PINK1 的遗传学互作,并且说明了这种遗传学互作依赖于自噬蛋白因子,但不依赖于 Parkin 或者其他线粒体蛋白翻译因子。
通过 FKBP-RAP-FRB 蛋白靶向诱导系统,作者确定了 TUFm 可以作为一种新的选择性自噬受体:如果将 TUFm 人为导向至过氧化物酶体,可引发特异的过氧化物酶体清除。通过筛选一系列 Ser/Thr 位点突变的 TUFm 蛋白,作者锁定了磷酸化位点 Ser222,并在体外磷酸化实验中用纯化蛋白进一步证实了 TUFm 为 PINK1 的磷酸化底物。
有趣的是,作者在细胞实验中发现线粒体膜电位去极化可以提高 PINK1 对 TUFm 的激酶活性,但机制不详。由于 PINK1 和 TUFm 都分布在线粒体和细胞质中,作者阐明了哪些部分的 PINK1 和 TUFm 参与了线粒体自噬的调控。令作者意外的是,磷酸化状态的 TUFm 可以抑制自噬而非磷酸化状态 TUFm 可以促进线粒体自噬,即 PINK1 依赖的 Ser222 的磷酸化决定了 TUFm 在线粒体自噬中的双重作用。
重要的是,除了体外哺乳动物细胞培养系统,这些结论也在帕金森症的果蝇病理模型中的多巴胺能神经元、间接飞行肌,以及变态发育过程中的果蝇中肠肠上皮细胞这些体内研究模型中得到验证。因此,作者证明了 PINK1/TUFm 普遍地参与了不同生理以及病理条件下的线粒体自噬过程,并且在进化上是跨物种保守的。
此外作者阐明了 p-S222-TUFm 主要局限于胞质中,在那里竞争结合更多的 Atg5 单体,从而阻碍 Atg5-Atg12 复合体的形成来抑制线粒体自噬。
最后,作者画龙点睛地研究了 PINK1/TUFm 是如何整合到已知的线粒体自噬调控机制中的:具体地讲,两个关键的 PINK1 依赖的磷酸化反应(p-S65-Ubiqutin 和 p-S222-TUFm)是如何协调的,以及具有自主双向调控能力的 PINK1/TUFm 具有哪些潜在优势。
通过数学建模以及实验定量分析,作者确定了同样依赖于 PINK1 的 p-S222-TUFm 和 p-S65-Ubiqutin 具有独特的动力学参数空间,其中的关键在于,相对于 p-S65-Ubiqutin,p-S222-TUFm 具有非常高的周转率(非常高的生成系数以及降解系数),因此很合适充当一个灵敏的开关元件。可以想象,这种独特的动力学参数空间是经过大自然筛选后被保留下来的。
数学模拟说明了 PINK1/TUFm 的自拮抗特性以及特定动力学参数的配合,赋予了线粒体自噬启动调控的抗噪特性:线粒体自噬的触发被延迟,在这个缓冲期中出现了一个强抑制的阶段用来过滤掉假阳性刺激信号,而且刺激越强,被激发的抑制越强;同时,双底物共用一个激酶进一步增加了响应体系的抗噪性(鲁棒性,robustness)。
总之,作者的这些发现揭示了一个迄今为止未知的、进化保守的线粒体自噬负调控机制,为线粒体自噬和线粒体自噬相关疾病提供了新的见解,为研究人员进一步探索线粒体自噬的整个调控格局提供了启发。新发现的这个不依赖 Parkin 的 PINK1/TUFm 信号通路可能与 PINK1/Parkin 介导的线粒体自噬调控通路同样重要,尤其是对于具有特定能量需求以及 Parkin 活性受限的哺乳动物神经元,PINK1/TUFm 信号通路由于其自身拮抗特性以及 TUFm 的泛表达属性,可能对线粒体自噬进行更全面、更安全、更稳健的调控。
除此之外,由于估计有超过三分之一的线粒体蛋白质其实是双定位蛋白,该研究也可能激发科研工作者对线粒体 - 细胞质双定位蛋白这个细胞学研究领域的兴趣。最后,论文对一个激酶及其两个互为拮抗的底物(PINK1/TUFm/Ubiquitin)的分析阐述,也增加了一个新的生物学模型来探讨自拮抗信号模块的基本动力学特性 [8],并且可能为合成生物学中的信号回路设计提供新的思路。
本研究论文由包括福州大学生命科学研究所生命科学学院、天津大学生命科学学院、清华大学生命科学学院、厦门大学生命科学学院、清华长三角研究院、东部战区疾控中心等学术研发机构共同完成。
福州大学的林晶晶、陈凯、陈文锋、姚益洲、倪世伟为本论文共同第一作者,东部战区疾控中心李越希教授、福州大学杨宇丰教授为共同通讯作者。
参考资料:
1. Lazarou M, Sliter D A, Kane L A, et al. The ubiquitin kinase PINK1 recruits autophagy receptors to induce mitophagy[J]. Nature, 2015, 524(7565): 309-314.
2. Koyano F, Okatsu K, Kosako H, et al. Ubiquitin is phosphorylated by PINK1 to activate parkin[J].Nature, 2014, 510(7503): 162-166.
3. Xiang G, Yang L, Long Q, et al. BNIP3L-dependent mitophagy accounts for mitochondrial clearance during 3 factors-induced somatic cell reprogramming[J]. Autophagy, 2017, 13(9): 1543-1555.
4. Chen M, Chen Z, Wang Y, et al. Mitophagy receptor FUNDC1 regulates mitochondrial dynamics and mitophagy[J]. Autophagy, 2016, 12(4): 689-702.
5. Bingol B,Tea J S,Phu L,et al. The mitochondrial deubiquitinase USP30 opposes parkin-mediated mitophagy[J]. Nature,2014,510(7505): 370-375.
6. Wang L,Cho Y L,Tang Y,et al. PTEN-L is a novel protein phosphatase for ubiquitin dephosphorylation to inhibit PINK1-Parkin-mediated mitophagy[J]. Cell Res., 2018,28(8): 787-802.
7. https://doi.org/10.1016/j.molcel.2020.10.007
8. Hart Y , Alon U . The Utility of Paradoxical Components in Biological Circuits[J]. Molecular Cell, 2013, 49(2):213-221.
来源:Plant_ihuman iNature
原文链接:https://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247517012&idx=6&sn=98c44dc5d17f6a4ca17cb031ec89f7b8&chksm=fce6f08bcb91799d4c12ba0a40c958f58e8de582de2ea674647c4916566ab3db05aaa4183df7#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
环境友好的农林害虫生态调控与生物防治技术——2017高级研修班总结

北方是家鸡的驯化中心?线粒体DNA分析不支持

浙大学者揭示脑卒中神经元线粒体自噬新规律

化学所线粒体自噬过程探针和干预自噬过程策略研究获进展

Mul1抑制Parkin介导的线粒体自噬机制的揭示
《自噬》发表武汉大学宋质银课题组线粒体自噬新成果
动物所发现线粒体自噬调控肝癌发生的新机制
Molecular Plant 出版“植物激素”专辑
张英梅/任骏团队揭示肥胖性心肌病线粒体自噬调控新机制
关于举办“环境友好的农林害虫生态调控与生物防治技术高级研修班”通知