科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-09
来源:BioArt
追溯近百年来的肿瘤病理学发展,病理学家不断观察到了癌细胞核形状、大小、染色质结构的变化,这些变化特征帮助病理学家确定癌症的分型和分级,对于癌症的治疗和预后都非常重要。然而,尽管重要性众所周知,可是这些形态学变化的分子基础仍不明确。分子和遗传学研究已经证明了人类肿瘤中广泛存在着表观遗传的缺陷(例如染色质调节子突变、DNA甲基化改变等)【1】。然而,染色体高级结构在癌症中的命运却仍然未知。
结直肠腺癌是非常常见的上皮肿瘤,尽管结直肠腺癌的研究已陆续发现了不少表观遗传学的改变,然而,这些表观遗传学的变化与基因组拓扑学有什么关联,大家还不清楚。
近日,哈佛医学院麻省总医院以及Broad Institute的Bradley E. Bernstein和Martin J. Aryee领导的研究小组在Cell杂志上发表题为Large-Scale Topological Changes Restrain Malignant Progression in Colorectal Cancer的研究论文,在这篇文章中,作者将结肠癌和正常结肠的拓扑图与表观遗传学、转录和成像数据进行整合分析后,发现与传统观点“肿瘤相关的表观基因改变主要是致癌的”相反,肿瘤中的拓扑变化实际上是细胞分裂积累的结果,这些变化不但抑制肿瘤细胞的干性,而且诱导了抗肿瘤免疫,实际上它可能具有抑癌作用。

为了了解结直肠癌细胞核结构是如何变化的,作者分析了原发性结肠癌、正常结肠和结肠癌细胞系中的基因组拓扑结构、DNA甲基化、染色质修饰以及转录因子的变化(图1)。作者进行了拓扑相关结构域(TAD)及其边界的探索,发现结肠肿瘤、正常结肠和细胞系的拓扑边界基本上是保守的,只有一小部分高甲基化肿瘤例外。
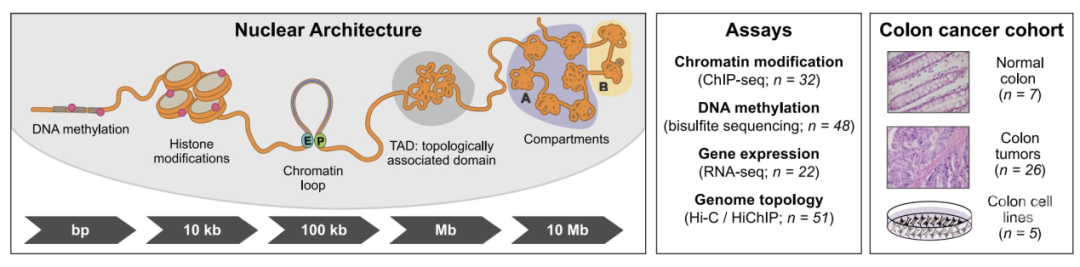
图1. 实验设计图
基因组总体可以分为两大部分:一部分是开放的、转录活跃的称为A区室(A compartment),另一部分封闭的、相对沉默的称为B区室(B compartment)。尽管正常结肠和肿瘤之间的分区基本一致,但A区室和B区室之间的远程互作在肿瘤中更为频繁。作者采用了最前沿的测序Hi-C【2】,结合生信分析、甲基化检测和成像技术,作者发现在A区室和B区室交界处存在一个重组的中间区室I区(Intermediate compartment),它在细胞核中的空间位置在中间,与常规的A区室和B区室相互作用。在肿瘤中,I区室普遍处于低甲基化,更趋近于B区室(图2)。
那么这个新发现的I区是否和不同的组蛋白修饰相关呢?作者进一步研究发现,在肿瘤中,除了其拓扑特征之外,I区的异染色质状态、转录和甲基化水平都与其他区有所不同。作者用去甲基化试剂5-aza处理结肠癌细胞后发现阻断低甲基化可能是结肠肿瘤细胞不同区域结构改变的基础。
随着细胞分裂的逐步积累,作者发现低甲基化和拓扑结构的差异逐渐显现,因此,这种拓扑结构的变化可能是细胞分裂积累的结果,并且可能是在细胞增殖过程中逐渐形成的。在正常的细胞核中,A、B和I区在空间上是分离的。在肿瘤或衰老细胞中,随着细胞分裂,区室特异性的表观遗传状态和拓扑变化逐步产生(图2)。
紧接着作者研究了区间重组对转录带来的影响,发现区间的重组会诱导肿瘤种系抗原(CGAs)和内源性逆转录病毒(ERVs)等抗肿瘤免疫有关的变化(图2),并抑制与Wnt信号、上皮-间质转化、侵袭和转移有关的基因。因此,肿瘤中显著的拓扑改变实际上与肿瘤抑制转录程序有关。
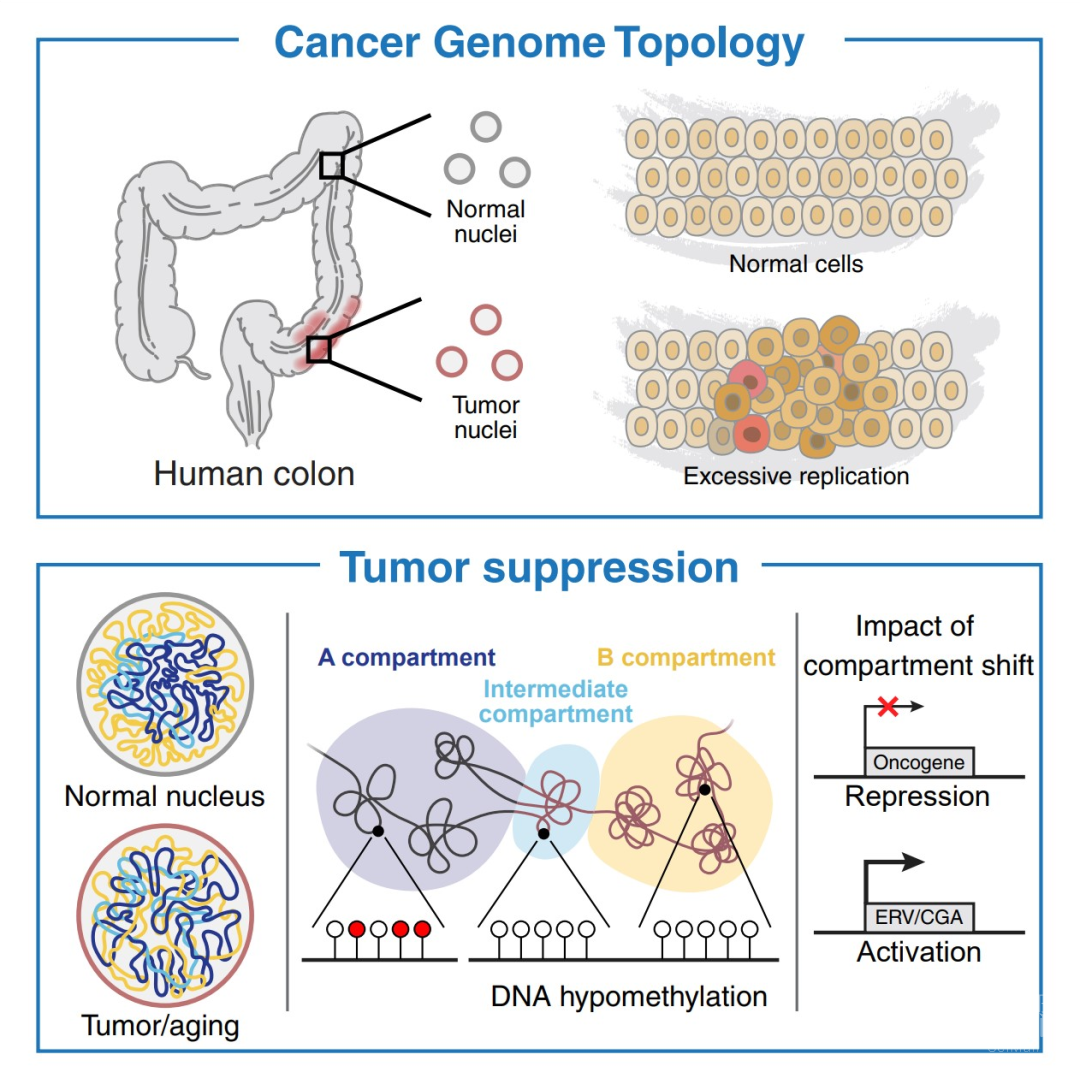
图2. 文章总览图
最后,作者还进行了结肠活检和肿瘤队列甲基化和表达数据分析,得出了肿瘤中拓扑学变化对肿瘤抑制作用的临床支持。首先,正常结肠活检的甲基化情况显示,年龄相关的B区和I区低甲基化与降低结直肠癌风险相关【3】。第二,结直肠肿瘤队列的检查显示,区室移位的转录特征可以预测患者的预后和转移的可能性。最后,泛癌分析表明,区室移位和肿瘤抑制作用也可能适用于其他上皮性肿瘤。
作者的结果对结直肠癌基因组拓扑学、甲基化和染色质状态进行了系统性整合分析,总结起来共三大突破:首先,原发组织的拓扑学数据揭示了一个结构上与经典的A区室和B区室截然不同的中间区I区。其次,通过比较肿瘤和正常结肠,发现B和I室的空间划分、核定位和表观遗传状态都发生了广泛的变化。第三,这些区域性改变与降低癌症风险和改善预后相关的肿瘤抑制表达程序相关。通常地,肿瘤相关的表观遗传改变通常被认为是致癌的,但本文中,作者的发现表明,肿瘤中的这些拓扑变化实际上抑制了肿瘤的恶性进展。未来对这些普遍存在的结构变化及其在癌症和衰老中的功能研究将会为疾病的早期发现、患者分层和治疗干预提供新的策略。
参考文献
1. Baylin, S.B., and Jones, P.A. (2016). Epigenetic Determinants of Cancer.Cold Spring Harb. Perspect. Biol. 8, a019505
2. Rao, S.S.P., Huntley, M.H., Durand, N.C., Stamenova, E.K., Bochkov,I.D., Robinson, J.T., Sanborn, A.L., Machol, I., Omer, A.D., Lander, E.S., andAiden, E.L. (2014). A 3D map of the human genome at kilobase resolution revealsprinciples of chromatin looping. Cell 159, 1665–1680.
3. Wang, T., Maden, S.K., Luebeck, G.E., Li, C.I., Newcomb, P.A., Ulrich,C.M., Joo, J.E., Buchanan, D.D., Milne, R.L., Southey, M.C., et al. (2020).Dysfunctional epigenetic aging of the normal colon and colorectal cancer risk. Clin.Epigenetics. 12, 5.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652507381&idx=1&sn=78b3137f4f95fe1d1ff7c313d27387b9&chksm=84e19f41b39616578c3dfe685ac4a7f9363208279381be6ba271442c0950676247f3f6948a85#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
第22届全国肿瘤防治宣传周启动仪式在北京举行




当DNA甲基化遇上RNA甲基化:果实成熟的表观遗传调控
基于拓扑学原理的声学超材料问世
拓扑学奠基人——江泽涵
【科技前沿】Protein & Cell综述 | 肿瘤的代谢重编程和表观遗传修饰: 调控机制及潜在的治疗策略
Cell:从拓扑学角度揭示DNA复制之谜

李大为教授团队Nature:在分子拓扑学方面取得突破性进展

当DNA甲基化遇上RNA甲基化:果实成熟的表观遗传调控
从七桥问题初探拓扑学思维
澳大利亚icon医疗集团访问中国抗癌协会秘书处

