科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-17
偏摩尔量partial molar quantity,在温度、压力及除了组分B以外其余组分的物质的量均不变的条件下,广度量X随组分B的物质的量nB的变化率XB称为组分B的偏摩尔量。偏摩尔量就是解决“体系组成的变化对体系状态影响问题的”。
定义方程式:
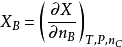
对于纯物质,并不存在偏摩尔量的概念,它就是摩尔量。
偏摩尔体积可以看作是某一定浓度溶液中1摩尔该组分对体系总体积的贡献。
在理解偏摩尔量时。要注意以下几点:
(1)只有均相系统的广度性质才有偏摩尔量。偏摩尔量本身是强度性质,它与系统的温度、压强及各组分的组成有关,而与系统内物质的总量无关。
(2)偏微分的条件必须是恒温、恒压。
(3)对于纯物质的均相系统,显然偏摩尔量即为该物质的摩尔量。1
分析我们知道,不论是什么体系,物质的质量(克)和物质的量(摩尔)总是具有加和性的。但是,体系的其他广度性质则不一定具有简单的加和性。以体积这一广度性质为例,两组分混合前的体积之和(V1+V2)与混合后的实际体积(V)并不相等,即V1+V2≠V。要找出规律,须引入“偏摩尔量”这个新概念。
在多组分(k个组分)的均相混合体系中,某一广度性质Z(例如V、U、H、G),是T和P和各物质物质的量n的函数,即
Z=f(T,P,n1,n2,……nk),显然,Z的全微分为若体系发生的过程为等温等压过程,dT=0,dP=0,则Z=f(nB,nC)
式中nC是除B物质以外的所有其他物质物质的量,B不同,nC也要相应变化。现令
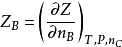
称为B物质的某广度性质Z的偏摩尔量。
从定义式可以看出,偏摩尔量的物理意义是:在等温等压下,往无限大的体系中加入1摩尔B物质而引起体系广度性质Z的改变量;或者是,在有限的体系中加入微量B物质dnB而引起Z的微小变化dZ之比。
例如,若VB表示水的偏摩尔体积,则其物理意义是在恒温等压下,往无限大的体系(此体系不一定是由水组成)中加入1mol水,体系体积的变化量;或往有限的体系中加入微量的水(之所以限制微量,是为了保证体系nC不变)而引起该体系体积的变化。GNaCl,m表示体系中氯化钠的偏摩尔吉布斯自由能,物理意义是往体系中加入微量氯化钠而引起该体系吉布斯自由能的变化量。1
问题1、只有广度性质才有对应的偏摩尔量。因为只有广度性质才与体系中物质的量有关。偏摩尔量也是状态函数,是强度性质。
2、只有均相多组分体系才使用偏摩尔量的概念。单组分体系的偏摩尔量等于其摩尔量。
3、对于均相多组分体系,也只有恒温等压,nC不变的条件下,体系的广度性质Z对nB的偏微商才是偏摩尔量。
4、热力学关系式中的广度性质(U、H、G等),用该广度性质的偏摩尔量来代替也成立。2
性质多组分体系的所有热力学关系均可写成以偏摩尔量表示的对应关系,即将单组分系统的摩尔量换成多组分系统的偏摩尔量即可,热力学函数关系并不发生变化。引入偏摩尔量。为多组分体系热力学函数的研究带来了很大的方便;系统的容量性质等于各组分偏摩尔量与其物质的量的乘积之和。如(A+B)二元溶液的体积V=nAVA+nBVB。加和性给出了体系的总量与各组分的偏摩尔量的关系。3
本词条内容贡献者为:
尹维龙 - 副教授 - 哈尔滨工业大学