科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-18
来源:BioArt
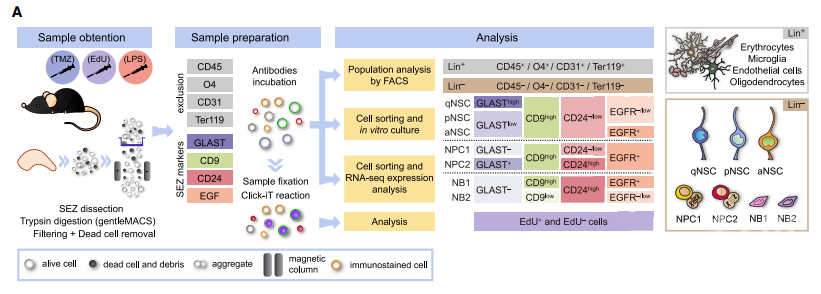
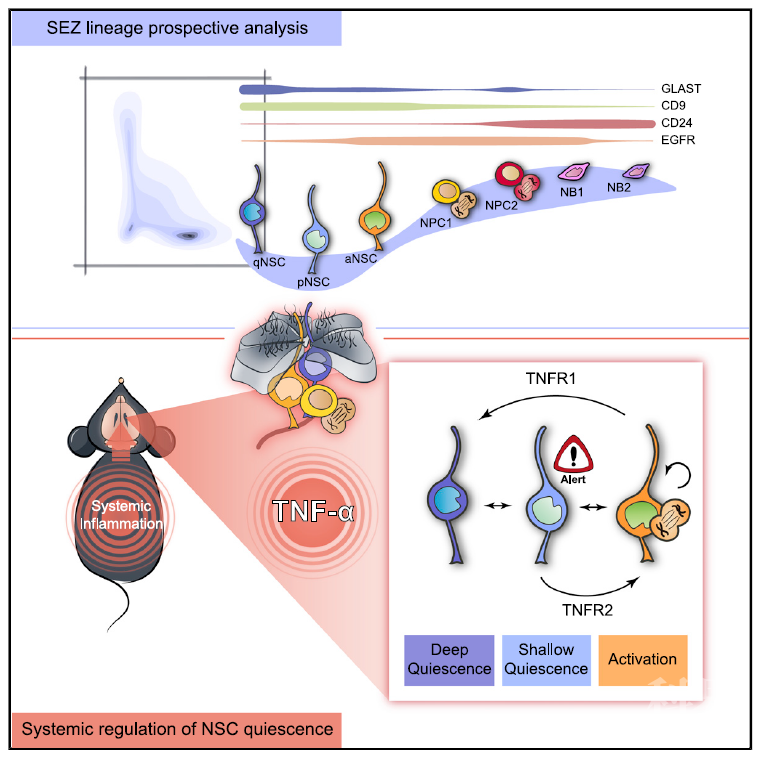
可逆的静止状态是组织特异性干细胞(stem cells, SCs)的一个特征,许多成年细胞龛位含有处于两种激活状态的SCs。虽然循环的SCs似乎负责生理细胞更新,但非循环的静态SC贡献仍不清楚。有研究报道,对肌肉的机械损伤不仅会导致其卫星SCs的局部激活,而且还会导致远处肌肉中的SCs转变为始发态,这些瞬态称为Galert【1】。这些SCs通过进入警报或启动状态来响应来自远处受伤组织信号的能力表明其感知机体环境的能力。虽然大脑与血液循环相对隔离,但可以通过血脑屏障和周围细胞因子诱导的小胶质细胞活化,对外周损伤的固有免疫激活被有效地转导为神经炎症【2】。然而,人们普遍认为炎症对哺乳动物的神经发生有害,尚未研究验证对哺乳动物神经干细胞(NSCs)状态的直接作用。2020年11月17日,来自西班牙瓦伦西亚大学的Jose Manuel Morante-Redolat 课题组和Isabel Fariñas课题组在Cell Stem Cell杂志上发表了一篇题为 “Adult Neural Stem Cells Are Alerted by Systemic Inflammation through TNF-a Receptor Signaling”的文章,在这项研究中,作者开发了一种多级策略分析NSCs的不同状态,以鉴定调节其静止或激活水平的信号,同时确认了促进NSCs“警觉性”的信号传导途径,从而建立了一个新概念,即SCs可以对系统环境作出响应。首先,作者开发一种不依赖于报告工具小鼠的流式细胞策略,将室管膜下区(subependymal zone, SEZ)谱系分离为九个类别(见下图1),紧接着完成转录组测序以进行下一步的分析。作者使用DNA烷基化药物TMZ消除了大多数增殖细胞如活化的NSCs(activated NSCs, aNSCs),而静止NSCs(quiescent NSCs, qNSCs)和始发态NSCs(primed NSCs, pNSCs)的数量未受影响,通过EdU和Hoechst标记显示qNSCs和pNSCs处于G0至G1期,但两者在细胞周期相关基因的转录方面有所不同,且pNSCs具有增加的细胞体积和线粒体含量,提示pNSCs虽然处于静止状态,但仍易于激活,因此作者决定接下来在体外对其进行功能性研究。在体外神经球(Neurosphere)培养中作者发现,aNSCs和神经祖细胞(neural progenitor cells, NPC)均可形成神经球,NPC衍生的神经球显示出降低的增殖能力;qNSCs不参与细胞周期且无法存活超过48小时。相比之下,pNSCs虽然在最初的24小时内没有分裂,但随后可以以较慢的速度形成可以亚克隆多代的神经球。图1,用于分析SEC的FACS流水线示意图为了获取对NSCs状态调节的新见解,作者通过GO分析并揭示了静态细胞中与“炎症”相关类别的富集,甚至962个炎症GO子类别中有一半特定与qNSCs以及pNSCs相关,这些数据提示炎症在SEZ中可能发挥复杂作用。为此,作者首先对腹膜内注射革兰氏阴性细菌产物脂多糖(LPS)的小鼠中不同SEZ种群特征的许多基因表达进行定量检测。与先前关于炎症对神经发生的负面影响的报道一致,许多基因发生下调。值得注意的是,NSC相关基因表达发生显著地瞬时增加(Gfap,Prom1,Cdkn1a,Id1或Fgfr3),且尽管LPS处理的小鼠增殖的SEZ细胞比例降低,但仍能产生更多的初级神经球,提示炎症反应可能有助于NSCs的有效活化。LPS处理可引起全身性炎症反应,且在上述GO分析中“TNF-α信号传导”是qNSCs和aNSCs间表达差异最明显的细胞因子途径,因此,作者想知道TNF-α是否可能在调节静止或激活平衡重发挥潜在作用?为此,作者决定首先通过监测在不同浓度的细胞因子存在下神经球的生长来测试TNF-α的作用,以及在不存在细胞因子的情况下进行继代培养时这些神经球产生次级克隆的能力。TNF-α以浓度依赖性的方式刺激或抑制神经球的形成,但是当以任何浓度的TNF-α生长的神经球被解离并铺在不含TNF-α的有丝分裂原中时,它们都会形成越来越大的次级球,这提示细胞因子可以促进自我更新分裂。那么,TNF-α是通过何种方式介导对NSCs的多效性作用呢?先前已报道TNF-α可以与两个单程跨膜受体TNFR1(也称为p55或TNFRSF1A)和TNFR2(也称为p75或TNFRSF1B)相互作用【3】。TNF-α处理Tnfrsf1atm1Imx或Tnfrsf1btm1lmx突变小鼠的神经球的实验表明,TNFR1的激活是细胞因子的细胞抑制作用的原因,而其对自我更新的影响只有在没有TNFR2的情况下才能消除。与此结果一致的是,用特异性TNFR2激动剂抗体处理可增加对称分裂和多能性,这些数据表明TNF-α通过TNFR2促进自我更新活化,并通过TNFR1促进细胞停滞。为了评估这些受体的功能相关性,作者用特异性激动剂处理了FACS分选的pNSCs和aNSCs。尽管TNFR2的刺激诱导了aNSCs形成的神经球的适度增加,但它却使pNSCs产生的神经球的数量显着增加了2.5到3倍。相反, TNFR1激动剂减少了pNSCs的活化,而对aNSCs没有任何影响,这些数据提示pNSCs是TNF-α的潜在靶标。总的来说,这项研究强调了NSCs可能感知并响应与循环中可检测到的内毒素水平相关的各种情况,并揭示了TNF-α在调节NSCs进入和退出静止状态中的双重作用。类似于成年斑马鱼大脑中的神经干细胞在受伤时被激活,炎症诱导的趋化因子的产生有助于它们启动再生神经发生【4】,显示出一种古老的生物应对损伤的响应机制。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652509114&idx=1&sn=a865d9c0485f984fe398ea4f402d5815
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
遗传发育所揭秘神经干细胞的内卷式竞争

学术造假必遭严惩,为何仍不断有人冒险
神经干细胞移植走向临床:回顾与展望
研究发现STING信号通路对神经干细胞的调控作用

复旦大学发现神经干细胞参与脑发育作用机制
研究人员揭示神经干细胞分化新机制
大脑中发现“焦虑细胞”,为治疗焦虑症提供新方向
新研究首次观测到神经干细胞的分裂过程

天价冬虫夏草能否抗癌成“罗生门”
广州生物院揭示神经干细胞分化新机制