科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-20
来源:BioArt
复杂的生物体是由众多细胞及其衍生物组成的,不同的细胞各司其职以支撑生命体正常发育,维持健康稳态。细胞迁移是一项影响发育,免疫,疾病的重要生理过程,细胞在生物体内迁移的机制也是科学家们长期探究的课题。传统观念认为定向的细胞迁移活动主要是因为化学因子的吸引或排斥【1】,近年来有研究发现细胞间的粘附分子【2】和组织的机械硬度【3】也会影响细胞的迁移。然而,体内组织本身是由大量相对稳定的细胞构成的,那么组织结构本身会对细胞迁移产生影响吗?
2020年11月20日,加州圣塔芭芭拉大学Denise Montell课题组在Science发表了题为Tissue topography steers migrating Drosophila border cells的论文。研究人员以果蝇卵室为模型,通过对迁移性细胞和周围细胞的四维影像分析以及物理建模,发现由周围细胞构建的组织结构同样影响细胞迁移路径,本研究拓展了人们对细胞迁移过程中体内微环境所起作用的理解。
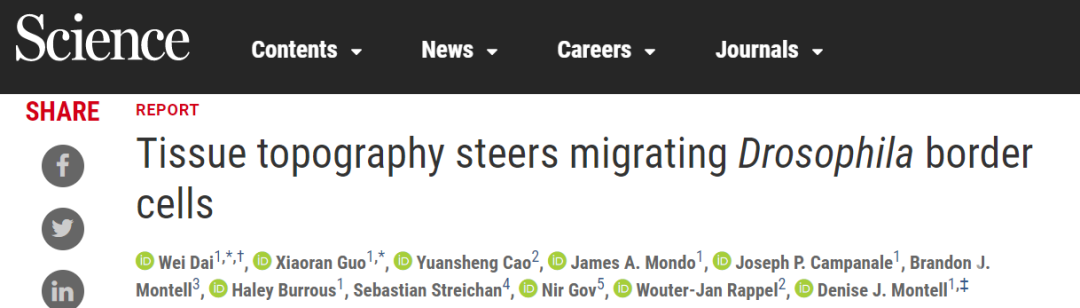
果蝇卵室的“边界细胞”在发育过程中需要从卵室前部迁移到后部的卵母细胞附近,为卵子的受精作准备(动图1)。作者发现迁移性细胞不仅按照从前部到后部这一已知方向进行迁移,还总是选择卵室的几何中轴线作为迁移路径,也就是说迁移性细胞还沿卵室外侧到内部路径进行迁移(图1)。通过观察果蝇卵室内化学吸引剂(chemoattractant)的分布浓度,研究人员发现它们的确呈现前低后高的分布模式,但并没有外侧低内部高的分布现象。此外,去除迁移性细胞的化学吸引剂受体虽然阻碍了细胞向后迁移,但对细胞向内迁移的影响很小。
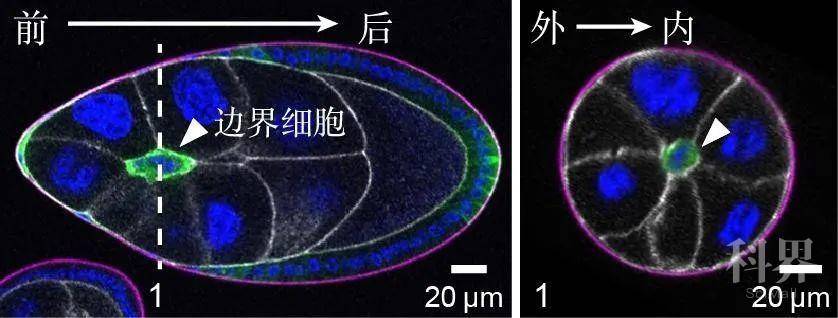
图1,“边界细胞”从前到后(左图)和从外到外(右图)的迁移路径
有什么样的情况可以阻止细胞向内迁移吗?在众多果蝇卵室突变体中,去除周围细胞表达的粘附分子E-cadherin的突变体有效阻碍了细胞向内迁移。然而,通过四维影像分析迁移性细胞与周围细胞的交互时,研究人员发现,粘附分子只是为迁移性细胞提供抓住周围细胞向内移动的必要牵引力。粘附分子并不能为迁移性细胞提供方向信息,因为粘附分子在各个迁移方向上的分布没有差别,且人为改变粘附分子的分布也不能影响细胞迁移方向。
排除了化学因子和粘附分子的作用后,作者通过对卵室组织结构三维重建分析,发现细胞在组织内排列成特定规则的空间结构,中间区域比外周区域存在更密集的多细胞分界点,相邻细胞越多分界点的间隙就越大(图2)。比起两个细胞形成的紧凑的边界空间,迁移性细胞的伪足更容易接触到这些多细胞构成的空间。
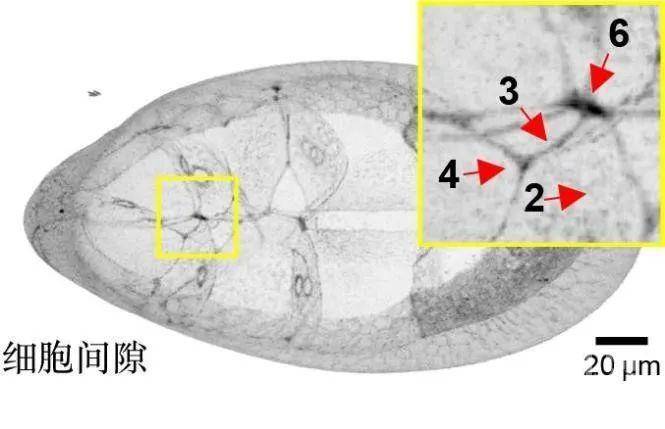
图2,相临细胞越多(从2到6),细胞间隙越大
通过物理建模,研究人员进一步确定了这些多细胞分界点“内密外疏”的特性主要影响了细胞向内迁移,而化学吸引剂“前低后高”的特性主要影响了细胞向后迁移(图3)。此外作者利用突变体果蝇,诱导周围细胞的数目异于正常,进而改变细胞排列的空间结构规则。在这些果蝇中,作者发现当多细胞分界点不再集中在中部,迁移性细胞会向新的分界点密集的地方迁移,而不再偏好整个卵室的几何中轴线,以此进一步证实多细胞分界点构成的组织“地形”的作用。
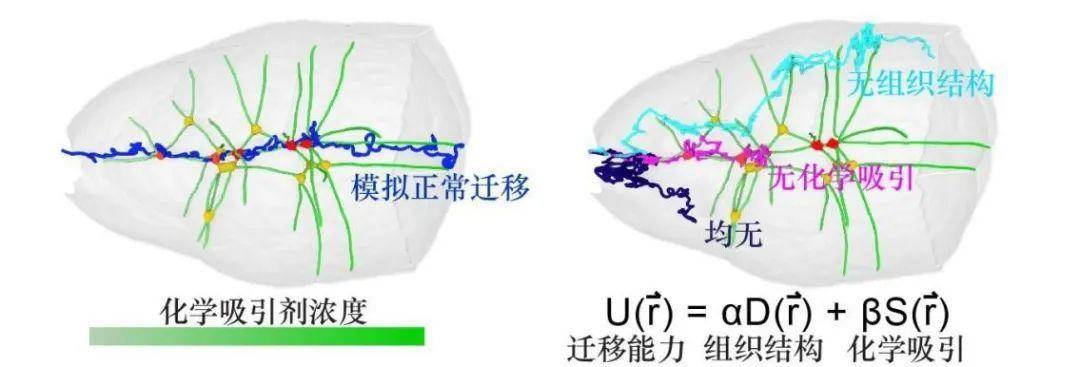
图3,物理模型解释化学吸引和组织结构对细胞迁移的影响
虽然迁移性细胞偏好多细胞分界间隙的相对“宽松”的环境,但是当化学吸引剂浓度足够高,而多细胞分界点密度相对降低时,迁移性细胞也会选择吸引力高但空间更窄的路径。原来不只是人,细胞也喜欢“偷懒”,但是如果吸引力足够大,它们也愿意多花力气去挤去争。
本研究揭示了组织拓扑结构对细胞迁移的影响,展现了迁移性细胞如何整合体内微环境中的物理和化学信息并最终确定迁移路径的原理。
本文的共同第一作者是博士后戴薇和博士生郭小然。戴薇博士现任哈佛大学医学院医学研究员。加州大学圣地亚哥分校Wouter-Jan Rappel课题组的曹远胜博士为本文提供物理建模技术支持。
参考文献
1. K. F. Swaney, C.-H. Huang, P. N.Devreotes, Eukaryotic chemotaxis: a network of signaling pathways controlsmotility, directional sensing, and polarity. Annu. Rev. Biophys. 39, 265–289(2010).
2. D. Cai et al., Mechanical feedbackthrough E-cadherin promotes direction sensing during collective cell migration.Cell. 157, 1146–1159 (2014).
3. E. H. Barriga, K. Franze, G. Charras,R. Mayor, Tissue stiffening coordinates morphogenesis by triggering collectivecell migration in vivo. Nature. 554, 523–527 (2018).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652509527&idx=1&sn=2a39dc99f85003ff8b9a72ab9d235e02
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

巨噬细胞胞外微环境代谢紊乱研究取得进展

关于单细胞测序刻画肝癌免疫微环境动态特征的研究

惯性迁移助力稀有细胞富集

《Science》子刊:磺化壳聚糖调控巨噬细胞,改善缺血微环境

细胞外囊泡通讯受微环境成分影响
一个小小的细胞就有多达4200万个蛋白质分子

人体细胞内存在“铁路”系统,能自动优化结构
失去细胞核的细胞在3D环境中举步维艰
细胞微环境可以影响炎症细胞的基因表达、调节免疫反应!

Nat Comm:单细胞水平解析肿瘤微环境的细胞代谢图谱