科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-20
来源:BioArt
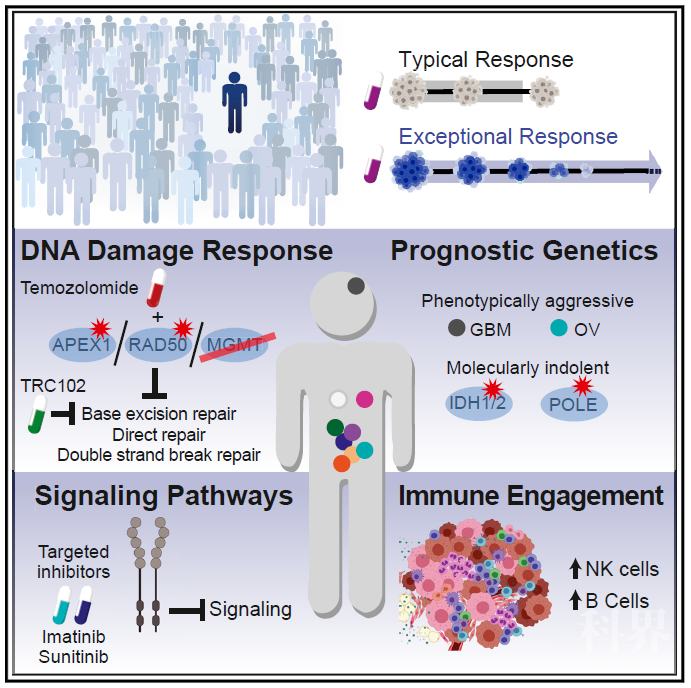
临床上肿瘤疗法通常只会在一小部分患者中产生治疗响应,这一部分患者与处于肿瘤同一阶段的患者相比,存活时间较长,被称为“特殊反应者”(exceptional responders ERs)。目前尚未有研究对ER的分子机制进行大规模深入探索。对此类患者的肿瘤进行基因分析可以深入了解影响治疗反应的调控因素。
2020年11月19日,美国国立癌症研究院Louis M. Staudt团队在Cancer Cell上发表题为Molecular Features of Cancers Exhibiting Exceptional Responses to Treatment的文章。该研究将多平台分析方法结合,建立无偏差的ER患者队列,对肿瘤活检组织基因组分析,系统阐述对肿瘤治疗反应产生特殊反应的分子基础。

在ER患者的研究中,将治疗反应持续时间是已发表的类似治疗研究中患者反应时间中位数的三倍以上定义为ER患者,通常具有不到10%的占比。按照这一标准,作者收集了111名ER患者的肿瘤标本,使用多种基因组分析方法检测基因突变、拷贝数变化、异常甲基化、异常基因表达和肿瘤微环境细胞组成。
对数据进行综合分析后,作者从26例样本中提出“一级”机制解释理论,包括脑肿瘤8例,胃肠道肿瘤6例,乳腺癌4例,胆管癌和肺癌各2例,胰腺癌、子宫内膜癌、卵巢癌和膀胱癌各1例。一级ER应答机制大致分为四类:DNA损伤应答;细胞内信号传导;预后遗传学和免疫系统参与。多个病例涉及到两种以上机制。
胶质母细胞瘤患者队列中,这些患者接受手术,卡莫司汀和放射治疗,复发后会给与替莫唑胺治疗,治疗后可以维持十年治疗效果。细胞内有两种修复替莫唑胺诱导的DNA甲基化修复方式:通过O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT O-6-methylguanine-DNA methyltransferase)对O6-甲基鸟嘌呤直接修复;N3甲基腺嘌呤和N7-甲基鸟嘌呤加合物的碱基切除修复。在胶质母细胞瘤患者队列中,MGMT启动子甲基化导致MGMT mRNA表达降低,从而使直接修复通路失活。而碱基切除修复通路的关键酶蛋白APEX1在此队列患者中会因突变而沉默表达。因此作者将此患者对替莫唑胺的特殊反应归因于基因组脆弱性,能够同时使修复替莫唑胺诱导的DNA的两个主要途径失活。再进一步分析发现替莫唑胺有效的ER患者中所有必要的DNA修复途径在基因组学上、表观遗传学和药理学方面都存在缺陷。
靶向肿瘤信号通路的药物最普遍使用的是曲妥珠单抗和贝伐单抗,在此ER队列中有14例使用。作者发现在乳腺癌或者胃肠道肿瘤患者中ER患者基因表达谱会向着有利于肿瘤治疗方向倾斜。此前也有报道在胰腺癌以及神经内分泌肿瘤中也会存在这一现象。
作者使用NanoString肿瘤免疫基因表达谱和免疫组化分析ER患者肿瘤中免疫细胞浸润情况。作者发现ER肿瘤中B细胞和激活型(CD56-dim)NK细胞数量比其他肿瘤中多。作者发现其中有一例患者携带有32个拷贝扩增的MDM2和IFNγ基因,二者表达水平也很高。在TCGA数据库中,约有5%的患者存在MDM2拷贝数扩增,但是和IFNγ同时扩增的情况较为少见。这或许是这例病人属于ER的原因。作者把ER患者中不同于常规肿瘤诊断,与良好预后相关的遗传学特征定义为“预后遗传学”(Prognostic Genetics)。
总结发现队列中62%的病例携带有两个以上的ER分子变化类别。 本研究发现大多数ER病例并不能仅通过DNA突变来分析解释。这也说明对于其他ER病例的分析需要进行多平台综合分析,这样的方法会改变以前对肿瘤的认知。将来也需要鼓励能够对这样的患者样本进行更大规模的研究。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652509527&idx=6&sn=713171a347780eecf8d23bd72be59497
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

中国肿瘤药物的创新趋势

分子农业!利用植物生产疫苗和药物
药物-聚合物杂化大分子工程:内嵌铂(Ⅳ)的可降解PEG用于肿瘤治疗
肿瘤防治宣传周丨神奇的肿瘤“定向爆破”——肿瘤靶向药物治疗,你真的了解么? 化疗药物和靶向药物的区别,你知道么?进来觅答案咯!

美批准首款治疗丛集性头痛药物

第三类形态:科学家首次揭示柠檬状病毒的秘密

第十六次全国临床药理学学术会议 第一轮通知
上海药物所发现增强纳米药物靶向肿瘤细胞新策略

Science:小分子药物抑制癌症“代谢检查点”助力T细胞杀死肿瘤
廖茂富团队揭示多重药物转运蛋白ABCG2传输抗癌药物分子的精确分子机制