科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-22
来源:brainnews
来源 | BioArt
神经退行性病变(Neurodegeneration)不仅会在成年人中出现,在一些病例中,神经元的退变也可以出现在婴幼儿期甚至是胚胎期。脑桥小脑发育不全 ( pontocerebellar hypoplasia, PCH) 就是这样一组常染色体隐性遗传的神经退行性疾病【1】。PCH具有表型的多样性,其共同特征包括脑桥小脑发育不全、萎缩以及运动障碍。其中部分患者出生后会表现出进行性加重的小头畸形和不同程度的脑室扩大、严重的认知障碍以及癫痫。此外,PCH也有遗传的异质性,目前研究发现了多个基因的突变可以致病,这些基因主要集中在几个通路上,包括DNA修复、蛋白质翻译、线粒体功能以及细胞的基础代谢等【2】。
哺乳动物的绝大多数基因都含有至少一个内含子,而且绝大部分多外显子(multi-exon)基因都会发生可变剪切。正确的RNA剪切对于基因的表达是必须的,这是细胞信息流从转录到翻译的重要中间步骤。在细胞内,RNA的剪切是由一个由多个蛋白和小RNA分子组装成的RNA剪切体(spliceosome)实现的【3】。RNA剪切体需要在pre-mRNA上经过多步组装形成成熟的复合体,最终完成剪切反应:剪掉内含子、连接外显子,最后生成携带有连贯信息的成熟mRNA。之前的研究主要集中在单个基因的剪切位点突变通过干扰RNA剪切而导致疾病,而编码RNA剪切体的组分基因突变导致人类疾病却很少被报道【4】。
2020年11月20日,美国加州大学圣地亚哥分校Joseph Gleeson课题组和英国利兹大学Eamonn Sheridan课题组合作在Neuron上发表了题为Mutations in Spliceosomal Genes PPIL1 and PRP17 Cause Neurodegenerative Pontocerebellar Hypoplasia with Microcephaly的研究论文,首次报道了编码RNA剪接体组分的基因亚效突变也可以导致这类神经退行性病变,并且揭示了一个脯氨酸异构酶在RNA剪切体中主要发挥支架蛋白而非催化酶的作用。

该研究首先通过全外显组或全基因组测序,在10个不同的家系里的18例患有脑桥小脑发育不全并伴随小脑畸形的病人中鉴定出PPIL1或PRP17基因的纯合(homozygous)或者复合杂合(compound heterozygous)突变。这些病人大多都伴随癫痫症状,并且一部分病人在出生后的几个月内死亡。PPIL1和PRP17都编码RNA剪切复合体的组分,它们在RNA剪切反应开始之前被募集到成熟前复合体中,并一直作用到剪切反应结束。体外实验发现病人的突变或影响蛋白的稳定性,或影响其与其他剪切复合体蛋白的相互作用。
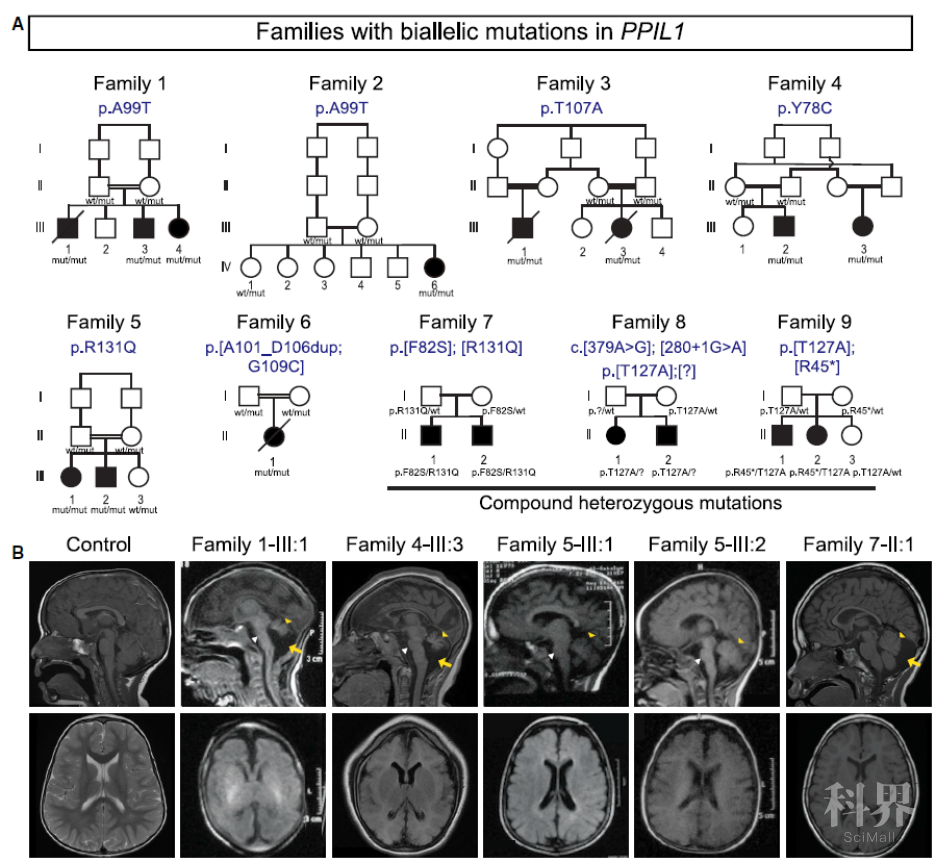
图1. PPIL1的隐性突变可以导致PCH
PPIL1在小鼠胚胎中广谱表达。完全敲除PPIL1或PRP17的小鼠呈现出早期胚胎致死的表型,而两种PPIL1病人点突变敲入(knockin)的纯合突变(homozygous mutants)小鼠可以存活到出生,并且表现出与病人类似的表型。在胚胎期,突变小鼠的脑中可以观察到大量神经元细胞特异性凋亡,并且伴随着神经干细胞数量的减少。
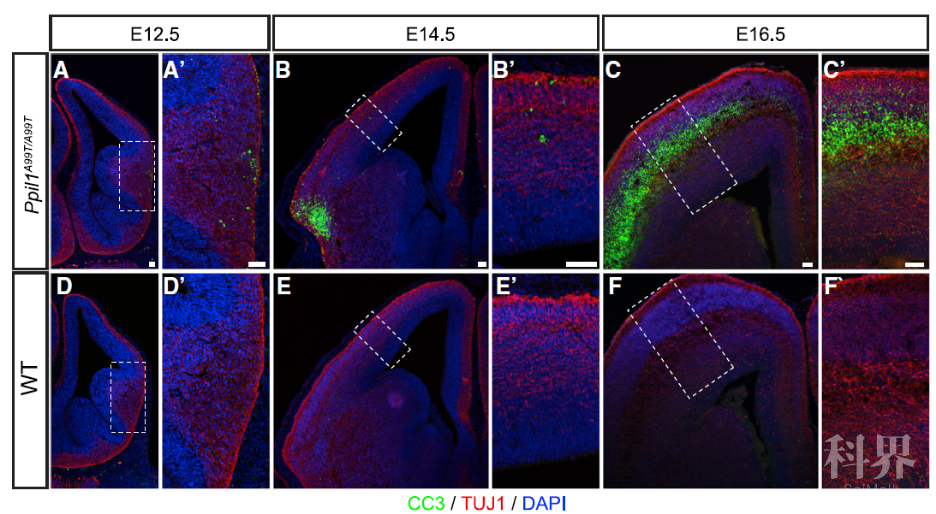
图2. 病人突变敲入的小鼠中出现大量的神经元细胞凋亡
接下来作者尝试探究PPIL1和PRP17对于RNA剪切是否是必须的。研究发现缺少PPIL1的细胞和脑组织都有大量基因可变剪切的改变。与对照相比,在胚胎期的突变体大脑组织中,作者一共发现了3797个显著的可变剪切变化,涵盖了2314个基因。生物信息学分析发现显著改变的RNA剪切主要集中在长度短、GC含量高的内含子上,或者是在弱的剪切位点上。功能和通路富集分析显示剪切显著改变的基因主要与细胞的基础生命代谢相关,包括了蛋白翻译和DNA修复等。缺少PRP17的细胞也表现出RNA剪切和细胞增殖的缺陷,而表达病人的突变蛋白并不能够逆转这一变化。
PPIL1编码一种脯氨酸异构酶,这种酶可以催化含有脯氨酸的肽键(X-Pro)顺式和反式的变化速度,从而能够促进底物蛋白的构象变化。在RNA剪切反应中,一共有八个不同的脯氨酸异构酶被募集到剪切复合体中【5】。但是,它们的底物蛋白是什么,以及它们是不是通过发挥催化功能来调控剪切反应仍然不清楚。
作者接下来尝试研究PPIL1调控剪切的功能机制。在多个RNA剪切体的cyro-EM结构中【6】,作者发现PPIL1的酶活中心能够结合PRP17蛋白的Gly94-Pro95肽键,并且体外实验发现PPIL1可以催化PRP17肽键构象的变化,从而证明了RNA剪切复合体中第一对脯氨酸异构酶和其底物蛋白。
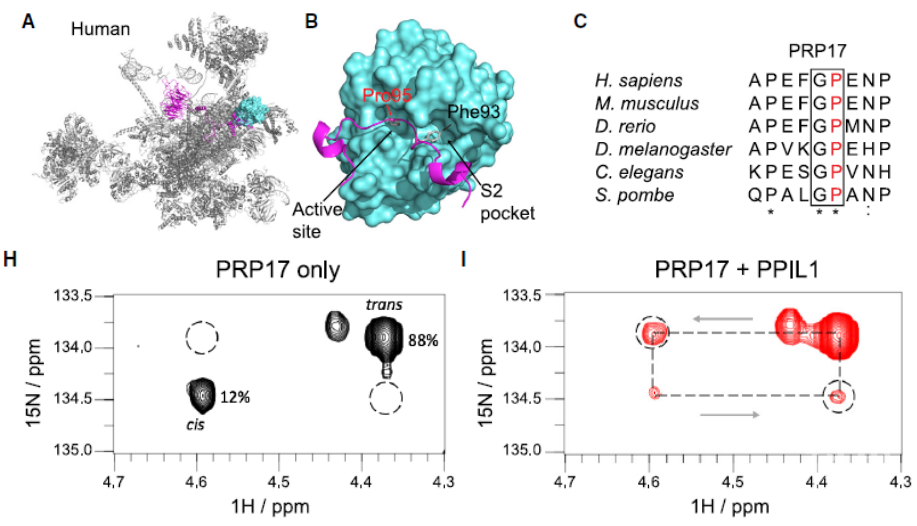
图3. PPIL1结合并催化PRP17 G94-P95肽键的异构化
最后,作者探究PPIL1作用于PRP17的催化功能对于RNA剪切和大脑发育是不是必须的。有意思的是,在细胞和小鼠中,不管是导致PPIL1酶活失活的突变(Arg55Ala)还是破坏掉PRP17 Gly94-Pro95的突变(Pro95Ala)都没有导致任何神经凋亡的上调,大脑发育的缺陷,或者RNA剪切的变化。这些结果说明PPIL1在RNA剪切体中主要行使支架蛋白作用。
综上,该研究发现编码RNA剪切体核心蛋白组分的基因的部分功能缺失可以引起大量基因的可变剪切变化,并导致神经元的大量凋亡。这一研究第一次将RNA剪切复合体功能缺陷与人类小脑畸形和脑桥小脑发育不全疾病联系起来。此外,该研究也揭示了一种脯氨酸异构酶在RNA剪切体中主要发挥支架蛋白而非催化的功能。
原文链接:
https://doi.org/10.1016/j.neuron.2020.10.035
参考文献
1.Cassandrini D, Biancheri R, Tessa A, et al. Pontocerebellar hypoplasia: clinical, pathologic, and genetic studies. Neurology 2010;75:1459-64.
2.Synofzik M, Puccio H, Mochel F, Schols L. Autosomal Recessive Cerebellar Ataxias: Paving the Way toward Targeted Molecular Therapies. Neuron 2019;101:560-83.
3.Shi Y. Mechanistic insights into precursor messenger RNA splicing by the spliceosome. Nat Rev Mol Cell Biol 2017;18:655-70.
4.Singh RK, Cooper TA. Pre-mRNA splicing in disease and therapeutics. Trends Mol Med 2012;18:472-82.
5.Rajiv C, Davis TL. Structural and Functional Insights into Human Nuclear Cyclophilins. Biomolecules 2018;8.
6.Zhan X, Yan C, Zhang X, Lei J, Shi Y. Structure of a human catalytic step I spliceosome. Science 2018;359:537-45.
来源:brainnews brainnews
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649579785&idx=4&sn=dafcbff502a2849ea62a538d5f4b87d2
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

这些癌症真的会遗传
从健康细胞到癌细胞,或许只需要几个突变
神经退行性疾病
神经退行性疾病的标记物

基因疗法可预防致命神经退行性疾病

衰老诱发神经退行性疾病分子机理获揭示

剪接体基因突变可导致婴幼儿早发性神经退行性疾病

基因突变原因何在?或许DNA自发突变定时器有关
病毒感染与神经退行性疾病有关

人类如何成为了长跑健将?只需一个基因突变