科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-14
来源:药学进展
中国药科大学(杭州)创新药物研究院
专家介绍:钟久昌

医学博士,教授,博士生导师。2010—2017年任职于上海交通大学医学院附属瑞金医院国家重点实验室、教育部重点学科上海市高血压研究所学术带头人、研究室主任。2018年起担任首都医科大学附属北京朝阳医院心脏中心行政副主任、高血压学科主任、医学研究中心首席科学家;北京市高血压重点实验室副主任;上海交通大学医学院博士生导师、博士后合作导师。现任国家心血管病中心高血压专家委员会常务委员、中国中药协会微循环用药委员会副主任委员、中华心血管病学分会高血压病学组和基础研究学组全国委员、中国药理学会表观遗传药理学专业委员会常务委员、中国高血压联盟理事、国际心脏协会中国转化医学委员会委员、中国医师协会心血管内科分会高血压专业委员会委员、中国病理生理学会生物活性小分子专业委员会委员及国际心脏协会中国分会青年委员。研究方向为心脑血管疾病药物靶点研究,先后主持国家重大研究计划、国家自然科学基金、国家重点基础研究发展计划项目及市科委等20余项科研立项。在国际上创新性提出ACE2/Apelin治疗高血压等心血管性疾病的重要理念,在国际心血管权威杂志Circulation、CircRes、Hypertension、Circulation:HeartFailure等上发表论文90篇,其中SCI收录50余篇;先后入选加拿大AHFMR青年学者、上海市浦江人才、香港荣华学者、上海市教育委员会/上海交通大学医学院高峰学科建设计划及上海交通大学优秀教师。主编和参编专著6部,参编全国性高血压专家共识与指南6篇。
正文
急性缺血性脑卒中损伤机制及其治疗药物研究进展
急性缺血性脑卒中,亦称急性脑梗死,具有高发病率、高致残率、高致死率的特点,严重威胁人类健康。诸多因素与脑卒中发病密切相关,包括年龄、性别、种族、吸烟、酒精摄入、高血压、高脂血症、心房颤动、糖尿病等。根据当前国际广泛使用的急性卒中Org10172治疗试验(TOAST)病因/发病机制分型,缺血性脑卒中可分为大动脉粥样硬化型、心源性栓塞型、小动脉闭塞型、其他明确病因型和不明原因等5型。在我国,急性缺血性脑卒中一般指发病后2周内,亦包括1周内的轻型脑卒中以及1个月内的重型脑卒中,急性缺血性脑卒中是最为常见的脑卒中类型,其占我国脑卒中发病人群的69.6%。我国卒中患者约1100万,每年新增240万,每年有110万人死于脑卒中,其中住院就治的急性缺血性脑卒中患者1年致残率为33.4%。脑卒中是现代社会致死和致残的最重要的血管事件,其防治成为医学领域亟待解决的重大问题,需关注其发病机制及潜在治疗靶点,规范诊治流程。
急性缺血性脑卒中的发生是由于脑动脉闭塞导致的脑组织缺血、梗死,伴有神经元、星形胶质细胞、少突胶质细胞的激活后损伤,其治疗策略主要集中在改善脑血循环和神经保护这2个方面,组织型纤溶酶原激活剂及血管内治疗可有效恢复血流,但其治疗时间窗窄、并发症多,而针对脑卒中发病靶点的神经保护剂,在临床试验中转化结果欠佳,故急性缺血性脑卒中的有效治疗亟需深入探究。本文现针对急性缺血性脑卒中的临床诊治现状及其潜在治疗靶点,包括兴奋毒性损伤与钙离子超载、氧化与硝基化损伤、凋亡以及免疫炎症损伤等情况作一概述,旨在为相关药物开发提供新的方向和理论依据。
1急性缺血性脑卒中治疗现状
目前针对急性缺血性脑卒中的治疗策略主要有:1)恢复缺血区血流、改善脑血循环,包括静脉溶栓、血管内治疗、抗栓治疗等;2)抑制缺血损伤导致的病理生理级联反应,即神经保护治疗。因此,应在尽量缩短就诊至血管再通时间,使梗死面积最小化,恢复缺血脑组织血液循环的基础上,充分保护神经功能。急性缺血性脑卒中的诊疗需多环节协调配合,完善脑卒中急诊救治体系,以期实现及时、有效的救治。对突然出现疑似脑卒中症状的患者,应进行简要评估和急救处理后,尽快就近送往有条件的医疗机构;卒中单元作为组织化的医疗模式,可明显降低脑卒中患者的致死/致残率;尽量在到达急诊室后60min内完成脑计算机断层扫描(computedtomography,CT)等基本评估并开始治疗;在排除非血管性疾病,完成脑CT/核磁共振(magneticresonanceimaging,MRI)检查排除出血性脑卒中,确诊急性缺血性脑卒中诊断后,应采用神经功能评价量表评估神经功能缺损程度,核对溶栓治疗/血管内机械取栓治疗的适应证和禁忌证,结合病史、实验室、脑病变和血管病变等资料进行病因分型,随后开始规范药物等治疗。
急性缺血性脑卒中由于治疗时间窗狭窄、禁忌证限制、并发症高风险,仅有少数患者接受溶栓、介入治疗,使其治疗有效率受限。与此同时,神经保护剂的研发和临床转化一直是治疗领域内的关注热点。但多个神经保护剂在临床试验中转化失败,其中原因可能涉及:药物治疗时间窗的把控、药物在缺血脑组织区是否达到有效治疗浓度、患者相较于临床前研究具有较大的个体差异等。因此缺血性脑卒中治疗药物的有效研发目前仍为世界性难题。
1.1静脉溶栓治疗
静脉溶栓是目前最主要的恢复血流的治疗措施,溶栓药物通过激活纤溶酶原形成纤溶酶,打破纤维蛋白分子间的交联,破坏血栓的完整性,继而达到溶解血凝块的作用。溶栓药物包括重组组织型纤溶酶原激活剂(recombinanttissueplasminogenactivator,rt-PA)、尿激酶和替奈普酶。我国目前使用的主要溶栓药为rt-PA和尿激酶,且其仅在一定治疗时间窗内有效(有效挽救半暗带组织时间窗为4.5h内或6h内)。上述药物对再灌注损伤无效,故在使用时需充分评估适应证和禁忌证,对可能的获益程度及承担风险进行充分评估,以保障医疗安全。rt-PA溶栓治疗除存在出血风险外,还有因血管源性水肿引起呼吸道梗阻的报道,应及时发现和紧急处理。
1.2血管内介入治疗
近年来急性缺血性脑卒中治疗领域内最重要的进展为血管内治疗,包括血管内机械取栓、动脉溶栓,可显著改善患者预后。动脉溶栓可使溶栓药物直达血栓局部,理论上可实现较高的血管再通率及较低的出血风险,但该获益可能被延迟的启动时间所抵消。因此,目前血管内机械取栓仍是一线的血管内治疗。此外,血管成形术(急诊颈动脉内膜剥脱术/颈动脉支架置入术)有助于改善脑灌注,但其临床安全性及有效性尚待明确。
1.3抗栓治疗
抗血小板治疗亦是缺血性脑卒中的防治基石之一,可减少血管内皮损伤处的血小板聚集,从而减少血栓及血凝块形成,使血管保持通畅。CAST(ChineseAcuteStrokeTrial)及IST(InternationalStrokeTrial)研究显示,卒中后48h内口服阿斯匹林,可显著降低随访期间的病死率或致残率,减少复发风险,仅轻度增加症状性颅内出血风险。POINT(Platelet-OrientedInhibitioninNewTIAandMinorIschemicStroke)研究显示,早期即发病12h内联合氯吡格雷和阿司匹林及双联抗血小板药物90d,亦可降低缺血性脑卒中的复发风险,但出血风险有所增加。血栓烷A2(thromboxaneA2,TXA2)作为血小板聚集和释放的强诱导剂,可导致动脉血管收缩,具有诱导缺血性脑卒中发生和促进其进展的作用。TXA2亦可破坏血脑屏障,与脑血管内皮细胞表达的血栓烷受体相作用,可上调炎症因子和黏附分子的表达,例如白细胞介素-8(interleukin-8,IL-8)、细胞间黏附分子-1、血管细胞黏附分子-1等,从而增加内皮细胞的通透性,导致血脑屏障的破坏。因此,使用药物抑制缺血性脑卒中患者脑组织中TXA2的过度生成、拮抗其受体的过度激活,可减轻脑组织的缺血损伤;TXA2生成所依赖的环氧合酶抑制剂、TXA2合成酶抑制剂以及TXA受体拮抗剂对于防治缺血性脑卒中有着重要的意义和价值。近年来新开发的选择性环氧合酶-1抑制剂例如三氟柳(1)、吲哚布芬(2),TXA2合成酶抑制剂的代表药物奥扎格雷(3),TXA2受体拮抗剂特鲁曲班(4)均在多项临床试验中表现出较好的疗效和较低的不良反应发生率,对于急性缺血性脑卒中的治疗有一定的意义及价值。
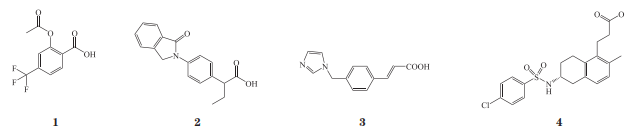
抗凝治疗对于特殊亚组的急性缺血性脑卒中可能有获益,但对大多数急性缺血性脑卒中患者,目前不推荐无选择地早期进行抗凝治疗;而对于少数特殊患者,需综合评估病灶大小、血压控制情况、肝肾功能,如若出血风险较小,致残性脑栓塞风险较高,可在充分沟通后谨慎选用。降纤治疗亦是急性缺血性脑卒中患者的常用治疗药物之一,包括降纤酶、巴曲酶、蚓激酶等。脑卒中患者在急性期血浆纤维蛋白原和血液黏滞度增高,降纤药物可显著降低血浆纤维蛋白原,并具有轻度溶栓和抑制血栓形成的作用。此外,扩容、扩血管药物等能否改善急性缺血性脑卒中患者预后,尚需大样本随机对照研究证实。
1.4改善微循环药物
除前述恢复大血管再通的治疗外,脑侧支循环的代偿程度亦与急性缺血性脑卒中预后密切相关。目前临床中常用的改善微循环药物为丁基苯酞,其是我国开发的1类化学新药,可改善缺血脑组织微循环、促进缺血组织血管新生从而增加缺血区血流量,进而改善急性缺血性脑卒中患者神经功能缺损及生活能力。另外,人尿激肽原酶亦为国内开发的具有改善脑动脉循环作用的1类化学新药,临床试验显示,相较于安慰剂组,人尿激肽原酶治疗组可安全地改善功能结局。
1.5神经保护剂
神经保护药物是溶栓治疗的重要辅助治疗之一,其可阻断缺血导致脑组织损伤细胞的代谢过程,其包括离子通道阻滞剂、抗氧化剂、抗炎药物等。神经保护剂依达拉奉是一种抗氧化剂和自由基清除剂,国内外多个随机、双盲、安慰剂对照试验提示该药能改善急性脑梗死的功能结局。胞二磷胆碱是磷脂酰胆碱生成的关键中间体之一,也是细胞膜磷脂生物合成所必需的物质,在脑缺血过程中其降解为自由基和脂肪酸,可通过恢复线粒体三磷酸腺苷酶的活性,从而激活并改善脑代谢,增强上行网状结构激活系统功能,有助于脑损伤后的脑功能恢复。多项随机、双盲、安慰剂对照试验对胞二磷胆碱在脑卒中急性期的疗效进行了评价,单个试验未显示差异有统计学意义,故其疗效还有待进一步证实。除上述药物外,我国指南亦建议进一步开展临床研究以寻找有利于改善脑侧支循环及神经保护的新药或新方法。
2急性缺血性脑卒中的治疗靶点和神经保护药物研发进展
急性缺血性脑卒中的发生是由于脑动脉闭塞导致的脑组织梗死,伴随着神经元、星形胶质细胞、少突胶质细胞激活后的损伤,其病理生理机制主要涉及细胞能量衰竭、钙离子超载、神经兴奋毒性、氧自由基过度激活、炎症免疫及凋亡自噬信号失衡等。神经细胞保护治疗可降低缺血区细胞损伤,是目前缺血性脑卒中治疗的研究热点之一。缺血区的脑组织会出现兴奋性神经介质释放和钙离子内流的现象,导致氧自由基损伤、细胞凋亡等一系列缺血性代谢损伤,最终使神经细胞受损、神经功能受影响。神经细胞保护治疗即是通过干预缺血区的异常病理生理过程,降低神经细胞损伤及其功能受损。
2.1钙离子通道阻滞剂及兴奋毒性的靶向药物
兴奋毒性损伤、钙离子超载是卒中发生后导致细胞损伤的主要原因,此为最早被确认、获得广泛认同的脑卒中损伤分子机制,广受关注。脑组织缺血后,神经元短时间内释放大量兴奋性神经递质(如谷氨酸),但由于细胞能量供给缺乏,兴奋性递质再摄取的功能严重受损,大量兴奋性神经递质累积,导致大量钙离子、钠离子以及氯离子内流入细胞,导致脑神经细胞水肿;与此同时,大量内流的钙离子激活钙离子依赖的激酶,例如磷脂酶、蛋白酶及核酸酶等,导致蛋白骨架大量水解,线粒体、细胞核被破坏,最终致使细胞损伤、死亡。
调控钙离子通道或神经递质类氨基酸受体的药物可发挥神经保护作用。钙离子通道阻滞剂(calciumchannelblocker,CCB)可通过抑制钙离子内流从而减少神经元突触前膜兴奋性氨基酸的释放及细胞内钙超载,并可通过使脑血管扩张而增加脑血流量。常用CCB药物有尼莫地平,其可透过血脑屏障,对缺血性脑卒中发挥神经保护作用。新型海洋真菌提取物xyloketalB通过减少钙离子内流、抑制细胞凋亡,从而发挥改善氧糖剥夺导致的细胞死亡的作用。谷氨酸及天冬氨酸为中枢神经系统兴奋性突触的神经递质,而N-甲基-D-天冬氨酸(N-methyl-D-asparticacid,NMDA)受体是兴奋性氨基酸的主要受体之一。NMDA受体中,NR2A亚型主要分布于突触,激活该亚型受体能促进细胞生存;而NR2B亚型主要分布于突触外,激活该亚型受体,能够激活死亡相关激酶1(DAPK1),从而诱导细胞死亡。通过干预NMDA受体的锚定蛋白,可在不影响NR2A功能的前提下,显著减少细胞死亡。特异性强、副作用小的CCB及靶向兴奋毒性的药物仍需进一步探索。
2.2抗氧化剂与硝基化损伤的靶向药物
干预氧化损伤和硝化应激可作为潜在的脑卒中治疗策略。缺血发生后,神经元等脑组织细胞会产生大量的过氧阴离子、过氧化氢以及羟自由基和过氧亚硝基阴离子等,再灌注时尤为显著。过氧亚硝基阴离子可促进蛋白质硝化和氧化、脂质过氧化,导致线粒体和DNA损伤、炎症反应激活、细胞坏死和凋亡,从而致使脑损伤。依达拉奉作为自由基清除剂,可清除超氧阴离子、过氧化氢和羟自由基,已在我国广泛用于治疗缺血性脑卒中。磷脂酰肌醇3-激酶(phosphatidylinositol3-kinase,PI3K)/蛋白激酶B(proteinkinaseB,AKT)通路的激活亦参与部分抗氧化剂的神经保护过程,因此,PI3K/AKT激动剂可通过靶信号神经氧化损伤从而治疗缺血性脑卒中患者。但需注意,PI3K/AKT信号与细胞增殖密切相关,故该通路激动剂类药物可能存在潜在致癌风险,故应在用于临床研究之前谨慎排除其潜在不良反应。既往研究显示,PI3K/AKT通路激动剂芝麻酚具有抗氧化作用,但其在体内可被快速清除,芝麻酚联合纳米结构脂质载体的给药方式,可减慢芝麻酚在体内的清除速率,从而更有效地发挥作用。与其类似的还有核因子E2相关因子2(nuclearfactorerythroid-2-relatedfactor2,Nrf2)激动剂,基于抗氧化活性从而发挥神经保护效应。有研究显示,原儿茶醛可以预防氧糖剥夺细胞模型脑缺血-再灌注(氧糖剥夺-恢复)引起的氧化损伤,其作用靶点涉及Nrf2/血红素加氧酶1通路。但是,Nrf2激动剂亦有促进肿瘤发展的作用。因此涉及Nrf2为靶点的相关药物的临床研发也应格外慎重。
2.3免疫调节剂与抗炎症损伤靶向药物
免疫调节剂和抗炎症治疗是缺血性脑卒中治疗重要手段。卒中早期即触发级联炎症反应,导致继发性损伤。缺血发生早期,脑组织会释放许多损伤相关模式分子(damage-associatedmolecularpatternmolecules,DAMP),进而触发无菌的免疫应答,DAMP通过激活小胶质细胞、中性粒细胞、淋巴细胞表面Toll样受体,激活固有免疫系统,通过NF-κB导致大量炎症因子释放,激活凋亡等死亡信号通路,最终引发脑组织缺血损伤。因此,脑卒中后免疫介导的炎症反应已作为脑卒中治疗的研究靶点,通过干预这些炎性介质,可显著减轻卒中后损伤程度。芬戈莫德为治疗多发性硬化的新型免疫抑制剂,是神经胺-1-磷酸盐受体激动剂,可阻止淋巴细胞从淋巴结外出,限制淋巴细胞脑部浸润,抑制小胶质细胞和巨噬细胞的局部激活等。在临床试验中,脑卒中发生72h内给予芬戈莫德治疗,无严重有害事件发生,可限制继发性脑组织损伤,提高功能恢复;脑卒中发生4.5h内联合tPA用药可减少神经功能缺陷。进一步研究需明确芬戈莫德发挥疗效的作用靶点和分子机制,以及避免该药潜在的不良反应。此外,趋化因子受体阻断剂通过调节炎症免疫通路对缺血性脑卒中具有一定的应用前景。CXC趋化因子受体4/7(chemokinCXCmotifreceptor4/7,CXCR4/7)通路可改善脑组织缺血后受损的神经功能,并逆转免疫反应。新近研究显示,CXCR4阻断剂CX549具有神经保护和神经营养效应,其可有效减弱小胶质细胞的活化,改善神经元损伤后的存活和行为功能,抑制炎性因子的表达,且其对CXCR4的亲和力更强。值得注意的是,虽然炎症反应在卒中急性期间促进细胞死亡,但在卒中发生后期,淋巴细胞及小胶质细胞在组织修复过程中起着重要作用。因此,针对卒中后免疫炎症反应的干预措施,必须根据卒中后各个时期炎症反应的特点,在减少炎症反应造成细胞损伤的同时,促进炎症反应在卒中后期的修复功能。
2.4ACE2-Ang-(1-9)-AT2R与ACE2-Ang-(1-7)-Mas相关激动剂
脑缺血导致的肾素血管紧张素-醛固酮系统(RAAS)激活和细胞凋亡增加是导致神经元后期死亡的主要原因之一。研究发现,RAAS主要效应子血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)通过其1型受体(AngⅡtype1receptor,AT1R)促进脑组织氧自由基和促炎症因子增加而损伤神经细胞,而其AT2R激活则具有神经保护效应。在新的RAAS中,血管紧张素转换酶2(angiotensin-convertingenzyme2,ACE2)可竞争性地作用于AngⅠ,使之催化产生Ang-(1-9)并经AT2R发挥作用,Ang-(1-9)经中性内肽酶或ACE作用进一步催化生成Ang-(1-7);ACE2还可特异性催化AngⅡ转化为Ang-(1-7),后者可通过其特异性受体Mas发挥负性调控RAAS的作用。ACE2-Ang-(1-9)-AT2R轴和ACE2-Ang-(1-7)-Mas轴通过对抗ACE-AngⅡ-AT1R路径,具有促进脑血管舒张、抗炎症、抗氧化损伤、调节免疫及抗脑细胞凋亡的功效(见图1)。
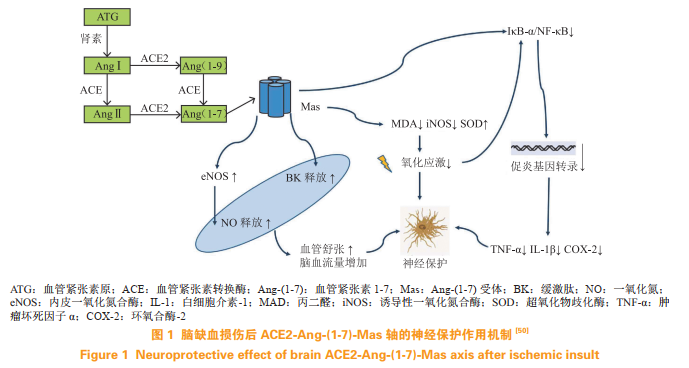
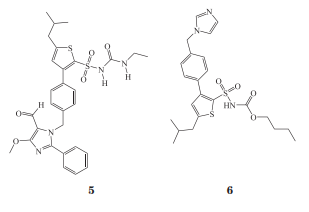
近年来,对ACE2-Ang-(1-9)-AT2R轴和ACE2-Ang-(1-7)-Mas轴的研究正成为缺血性脑卒中防治靶点研究的新热门方向,并且已经开发出了新的AT2R激动剂、ACE2激动剂及Mas受体激动剂,如重组ACE2(rhACE2)、ACE2激动剂和Ang-(1-7)激动剂,包括低聚糖胶囊包裹的Ang-(1-7)、环化Ang-(1-7)、NorLeu-Ang-(1-7)、CGEN856S(肽类)和AVE0991(非肽类)(5)。目前已开发出4种靶向AT2受体的候选药物,分别是肽类激动剂β-Ile5-AngⅡ、β-tyr4-AngⅡ、LP2-3及非多肽类特异性激动剂复合物21(C21)(6)。β-Ile5-AngⅡ和β-tyr4-AngⅡ是AngⅡ类似物,由于AngⅡ中的α-氨基酸残基Ile5和tyr4被β-氨基酸残基所替代,其对AT1受体的亲和力几乎完全消失,而对AT2受体的亲和力仅有轻度下调。β-tyr4-AngⅡ和β-Ile5-AngⅡ可通过NO依赖的机制引起小鼠动脉血管轻度舒张。C21可通过激活AT2受体介导血管舒张,发挥其抗纤维化和抗炎症功效。LP2-3是环化Ang-(1-7),后者可部分激动AT2受体,在发育不全动物模型中LP2-3可抑制血管的病理性重构。此外,C21是首个被研究的非肽类AT2R激动剂,其可以改善早期和晚期缺血性脑卒中的结局并减少缺血组织的细胞凋亡,涉及的细胞因子包括脑源性神经营养因子、IL-10等。开发ACE2-Ang-(1-9)-AT2R轴和ACE2-Ang-(1-7)-Mas轴的激动剂可成为缺血性脑卒中早期干预策略,因此尚需更多研究来阐明其在体内的作用机制。
3结语与展望
近年来在急性缺血性脑卒中的防治以及降低死亡率改善预后方面取得了一些成效,在其发病机制、治疗靶点等方面亦有新的发现,ACE2、AT2R和Mas受体激动剂的神经保护作用已被众多研究证实。重视规范脑卒中的干预策略,规范院前处理流程,尽量缩短进院至血管开通等干预治疗时间,及时给予有效的神经保护剂,需同时对脑卒中的治疗靶点及药物进行大力探索,考虑到缺血性脑卒中复杂的神经损伤机制,结合不同病理生理机制的神经保护方法,减少不良反应的发生风险,以期降低缺血性脑卒中的致残率、致死率,保护损伤的神经功能。阐明RAAS新成员ACE2-Ang-(1-9)-AT2R轴和ACE2-Ang-(1-7)-Mas轴分子作用机制,为急性缺血性脑卒中新型防治药物的开发和运用提供科学的理论依据,具有重要的临床价值和治疗意义。
来源:ppsyxjz 药学进展
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5MDY3ODExNQ==&mid=2651307435&idx=1&sn=9f3c40e03ca9f3e8da08faab22ca2ae9&chksm=8bf4eba7bc8362b17eb8f946b06021c2c7be01b34e2ec1960b16961f1879b5c174bcebd53ab5&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

美国缺血性脑卒中指南要点:推荐小卒中双抗治疗21天

“促癌黑手”Ter细胞首次发现

急性缺血性脑卒中患者围溶栓期护理知多少?

人工细胞与生物细胞首次实现成功融合与协作

学术造假必遭严惩,为何仍不断有人冒险

护理团体标准解读:缺血性脑卒中静脉溶栓护理

天价冬虫夏草能否抗癌成“罗生门”

“坏胆固醇”水平过高可致缺血性脑卒中风险增加
失去细胞核的细胞在3D环境中举步维艰
暨南大学陈填烽团队Sci. Adv:金属有机框架复合纳米药物治疗缺血性脑卒中