科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-12-05
来源:BioArt
动物细胞可以利用各种各样的机制来减缓或阻止病毒的复制,这些机制通常是由抗病毒蛋白介导的,其表达和活性可以是组成性的,但通常会被干扰素诱导放大。在这些干扰素刺激的蛋白质中,干扰素诱导的跨膜蛋白(IFITM)家族的成员无疑是独一无二的,因为它们可以阻断病毒和宿主膜之间的膜融合,在病毒穿过细胞的脂质双分子层之前就阻止其感染。目前,至少有三种人类IFITM蛋白——IFITM1、IFITM2和IFITM3具有抗病毒活性。这些活性限制了许多病毒在细胞中的感染,包括登革热病毒、埃博拉病毒、甲型流感病毒、严重急性呼吸道综合征冠状病毒和西尼罗河病毒【1,2】。
在哺乳动物中常见IFITM基因重复,且其可通过维持高度保守的抗病毒核心氨基酸区域来增加细胞膜的抗病毒覆盖,该区域具有不同的N-和C-末端来决定蛋白质的定位和相互作用。研究证实IFITM3是细胞抵御流感病毒的重要的干扰素刺激基因(ISG),此外,尽管IFITM1和IFITM2在过表达时具有与IFITM3相似的抗病毒活性,但并不能弥补IFITM3的缺失功能。IFITM3是一种分子量为15 kDa的膜相关蛋白,主要定位于核内体和溶酶体。事实证明,受到IFITM3限制的一长串病毒中,它们的膜融合反应通常发生在IFITM3最丰富的核内体中,而IFITM3的内吞作用和选择性核内体定位是由其N端AP2排序基序YEML介导的。研究发现SRC激酶介导的该基序上Y20位点的磷酸化,可导致IFITM3在质膜上的积累,不仅可以防止内吞作用,还可以防止蛋白酶体的降解【3】。携带IFITM3单核苷酸多态性(SNP)rs12252-C等位基因的个体显示出甲型H1N1流感病毒和新型冠状病毒的发病率和死亡率增加,而这个SNP位点被预测可编码IFITM3 N端包含Y20位点的21个氨基酸【4】。研究认为,IFITM3可能是通过增加核内体细胞膜的“刚性”来限制病毒融合,从而发挥抗病毒效应分子的作用。
然而,倘若你以为IFITM3只是一个单纯的抗病毒感染的核内体蛋白,那就大错特错了。IFITM3被发现在多种癌症中过表达,其表达水平与组织病理分级和分期相关。那么,这与IFITM3经典的抗病毒机制是否有关呢?又或者这背后有着什么新的机制呢?
近日,来自美国耶鲁大学的Markus Müschen团队在Nature上在线发表文章 IFITM3 functions as a PIP3 scaffold to amplify PI3K signalling in B cells”,发现IFITM3 是B细胞白血病和淋巴瘤的预后不良的强有力的预测因子,揭示了IFITM3在核内体内的抗病毒效应之外,其在B细胞表面的新功能,即在B细胞遇到抗原后发生的IFITM3的磷酸化,诱导了IFITM3从核内体的抗病毒效应功能动态转换为其在细胞表面的PI3K信号扩增作用。

本文研究人员发现,在正常的静息B细胞中,IFITM3的表达极低,但是B细胞受体(BCR)的参与以及PI3K信号通路的急性激活都可以强烈地诱导其表达。B细胞恶性肿瘤中IFITM3 mRNA水平普遍高于正常对照组,并且IFITM3 mRNA水平的升高与B细胞恶性肿瘤患者(包括小儿和成人急性B淋巴细胞白血病B-ALL以及套细胞淋巴瘤MCL)临床预后差有关。而BCR-ABL1(BCR-ABL1融合基因是慢性髓系细胞白血病发病机制的必要条件)激酶的抑制则可以使IFITM3的表达水平降低。
一方面,研究人员利用小鼠模型发现,在Ifitm3缺失(Ifitm3-/-)的B细胞前体中,CD19(B细胞常见的表面受体,在BCR信号中促进SRC激酶和PI3K信号通路)的表面表达显著减少,MYC和BCL2的表达以及PI3K信号通路相关基因表达减少,而细胞凋亡增加、增殖减少。用表达Ifitm3(Ifitm3+/+)的B细胞重组的μMT小鼠可以产生约5%的NP-特异性生发中心B细胞,而Ifitm3-/-的B细胞则无法重组产生这类细胞。同样的,在Ifitm3缺失的情况下,脾脏中的滤泡数、PNA+生发中心B细胞以及IgM、IgG1和IgG2b抗体的产生均减少。由此证明IFITM3对B细胞亲和成熟至关重要。
另一方面,研究人员利用BCR-ABL1和NRASG12D对Ifitm3+/+和Ifitm3-/-B细胞前体进行转化,发现诱导白血病和淋巴瘤的癌基因不能转化Ifitm3-/-细胞。B-ALL小鼠模型中的Ifitm3-/-白血病细胞(Ifitm3-/-B-ALL细胞)在存活和增殖方面表现出多种缺陷,在半固态甲基纤维素中形成集落的能力明显降低,在免疫缺陷小鼠中的移植并未发展为明显的白血病。同样的现象也出现在MCL细胞中。同时,两种模型中Ifitm3-/-细胞在BCR参与下均表现为Ca2+释放缺陷,CD19表面表达部分缺失,BCR诱导的CD19和LYN(B细胞中最主要的Src家族成员,在BCR信号中起着重要的启动作用)之间的信号放大也没有发生。由此提示IFITM3对促癌信号的发展也有着关键影响。
随后,研究人员发现,模拟Y20位点磷酸化的IFITM3(Y20E)或者被BCR-ABL1诱导的Y20位点磷酸化的IFITM3均可定位与细胞膜,因此表明Y20位点的磷酸化诱导了IFITM3从核内体的抗病毒功能动态转换为细胞表面的BCR或癌基因信号(图1),那么这是否足以激活致癌信号呢?答案是肯定的。
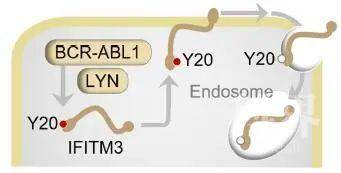
图1 由SRC(LYN)或致癌酪氨酸激酶(BCR-ABL1)调控的IFITM3的动态转换
在携带了BCR-ABL1敲入等位基因(该基因不易引起白血病)的癌前B细胞中过表达野生型和IFITM3(Y20E),后者的表达大大增加了前体B细胞形成集落的能力,诱导致癌信号,并引发白血病。进一步地对患者源性B-ALL细胞中IFITM3 Y20信号转导进行磷酸蛋白质组学分析发现,膜结合的IFITM3 Y20的参与诱导了CD19多个残基(包括Y531,其介导了PI3K的激活)上的磷酸化,并且参与了BCR和整合素受体信号通路的多个组分,这些均与PI3K的激活相关。通过N-连接糖基化位点生物素标记富集细胞表面蛋白,研究人员鉴定出65种表面受体,其中大部分与Ifitm3-/-B-ALL细胞中下调的脂筏成分相关,包括CD19、BCR相关受体和粘附受体。同样地,基于BirA生物素连接酶与携带细胞外血凝素(HA)标签的IFITM3(Y20E)的N端融合,在B-ALL和IgM+MCL细胞中进行酶催化近距离标记研究也证实,IFITM3相互作用蛋白包括BCR、整合素受体和PI3K信号元件。在BCR参与时,IFITM3和BCR信号链CD79B之间可诱导形成复合物,BCR和IFITM3在几分钟内即可诱导相互作用,30分钟后分离。因此进一步表明,BCR介导的SRC介导的IFITM3 Y20磷酸化的激活诱导IFITM3在质膜上的积累,使得IFITM3在BCR分子附近作为CD19和LYN的支架发挥作用,以实现信号的进行性放大。而这个支架作用是通过IFITM3选择性结合PIP3来完成的。研究发现IFITM3的缺失、以及SCR激酶LYN和CD19-PI3K信号通路活性的降低,都可广泛影响脂筏的形成和BCR信号短路,PIP3与PI3K的底物PIP2的比率也显著降低。进一步的实验证实IFITM3不仅可以通过增加PIP3的数量,也可以通过选择性地与PIP3结合并将其整合到脂筏的信号复合物中来促进PI3K的信号转导(图2)。
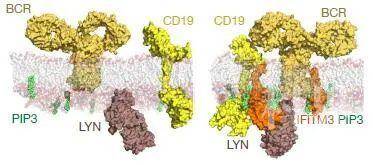
图2 IFITM3介导的CD19和LYN信号放大的结构模型
综上所述,在Ifitm3-/-B细胞中,脂筏中的PIP3缺失,导致脂筏相关的BCR和整合素受体信号传导出现明显缺陷。IFITM3依赖性的PI3K信号放大,部分作用于BCR和粘附受体的下游,对于快速扩增成具有高度抗原亲和力的B细胞至关重要。此外,多个癌基因也依赖于IFITM3来组装PIP3依赖的信号复合物并放大PI3K信号以进行恶性转化。由此发现了IFITM3磷酸化后位置结构的动态变化所带来的功能上的转换,揭示了IFITM3作为PIP3支架在PI3K信号扩增中的作用。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652512816&idx=5&sn=ca5532a4caf3fae92e316c7e11e48686
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

“科学”流言榜┋杨柳絮、5G信号传播新冠病毒?

李月明团队揭示先天免疫系统反应蛋白IFITM3在阿尔茨海默病中的作用
信号树

辟谣丨4月“科学”流言榜:杨柳絮、5G信号传播新冠病毒?
《自然》发文:麻省理工学院发现海洋中一种未知病毒

我国首个P4实验室正式运行,致力于最危险病毒研究
信号处理

4月“科学”流言榜:杨柳絮、5G信号传播新冠病毒?来看真相!
宇宙可能到处都是外星病毒,或成发现外星人首个迹象

评论:“坏兔子”病毒闹心,怎样才能将网络恶棍拦在门外