科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-12-06
来源:BioArt
核糖体产生蛋白质的翻译过程可能受到各种因素的干扰,例如mRNA损伤、特定tRNA不足或核糖体缺陷等。如果蛋白质合成在核糖体遇到终止密码子之前被干扰,细胞需要激活“核糖体相关质量控制(ribosome-associated quality control, RQC)机制”【1】,来释放停滞的核糖体,并降解mRNA及其相关的异常多肽。这种监控系统对维持细胞稳态非常重要,一旦错误蛋白质逃逸机体的这些监督机制,它们就会在机体内形成“异常聚集物”。真核生物的线粒体中存在独立的翻译体系,人体的线粒体核糖体(mitoribosome)负责合成13个组成氧化磷酸化复合物的基本蛋白亚基。异常翻译蛋白聚集物对线粒体功能也是有害的,会破坏向它们向所在的细胞提供化学能,并对某些神经元产生毒性从而导致神经病症例如阿尔兹海默病和帕金森氏病的产生【2】。由于目前缺乏线粒体的体外翻译(in vitro translation)体系,线粒体中是否存在拯救(Rescue)停滞的核糖体的机制在领域内一直存在争议,具体参与的蛋白因子仍然未知。
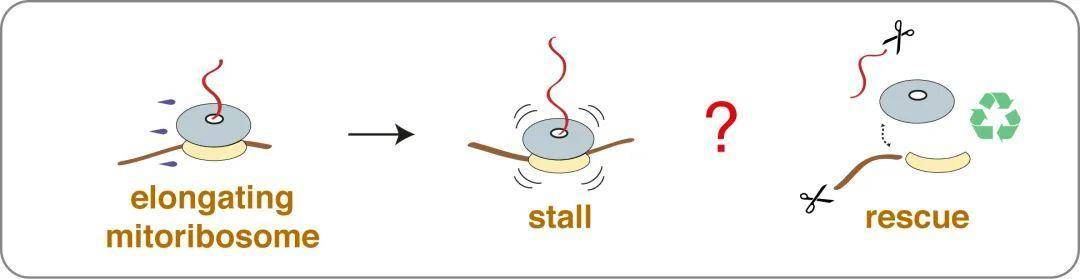
图1:线粒体翻译中停滞的核糖体解救机制未知
近日,剑桥大学MRC-LMB的Venki Ramakrishnan教授(2009年诺贝尔化学奖得主)课题组在Science杂志上发表了题为“Elongational stalling activates mitoribosome-associated quality control”的文章(共同第一作者为博士生Nirupa Desai,博士后杨涵婷博士和Vish Chandrasekaran博士)。在这项研究中,作者通过结构生物学的方法,发现了一种新的线粒体核糖体相关质量控制(Mitoribosome-associated quality control, mtRQC)途径可以拯救停滞的核糖体,并确定了与它们的底物(线粒体核糖体的大亚基mtLSU)相关的拯救因子(Rescue factors)结构。另外,作者解析了线粒体翻译过程的延伸途径中几乎所有状态的核糖体电镜结构,还观察到了在翻译循环的不同阶段将合成肽链共翻译插入膜(co-translational insertion)的核糖体与转运蛋白复合物结构。

本文作者从已知会引起线粒体中翻译停滞的人类突变体细胞系(PDE12-/-HEK293T)中提取线粒体,然后从这些线粒体中纯化了核糖体,利用冷冻电镜技术对超过300万个颗粒进行详尽分类和分析,得到了11个分辨率为3.1 Å– 4.4 Å的不同状态的线粒体核糖体及相关因子复合物结构。
首先,作者发现了一种新的线粒体核糖体相关质量控制途径来挽救停滞的核糖体,这一首次发现的途径,在质量控制的救援期间可以从停滞后分裂的核糖体大亚基释放未完成的多肽。
由于ΔPde12突变体细胞系的应用,该研究中观察到相当大比例的停滞的55S线粒体核糖体(图2B)。同时,作者还观察到了两类在翻译终止前停滞而分裂的大亚基mtLSU的结构,它们带有附着的tRNA和未完成的新生多肽(图2C, D),代表了迄今未报道的mtRQC中间体。第一类质量控制中间体mtLSU被解析为3.1Å分辨率,包含P位点和E位点tRNA,通过桥接与邻近蛋白之间的相互作用以及跨越tRNA间空间的其他因子来固定tRNA,E位点tRNA也通过与uL1m的D环相互作用进一步稳定(图2C)。
确定为3.3Å的第二类mtLSU代表了新生链水解之前的救援中间体。该复合物包含一个肽基tRNA,该肽已募集了释放因子异二聚体,释放因子C12orf65(被命名为“线粒体拯救途径的释放因子,以下简称mtRF-R”)和RNA结合蛋白MTRES1。mtRF-R在LSU的A位点靠近肽基tRNA,而MTRES1包裹在肽基tRNA的反密码子茎环上。这两种蛋白质通过mtRF-R的C末端螺旋和MTRES1的S4样结构域相互作用形成异源二聚体(图2D,E)。对两种分裂后类别的LSU结构进行比较,揭示了mtRQC途径中的事件顺序(图2A)。
作者得出结论,第一类是LSU的早期分裂后状态,它充当mtRF-R结合肽基转移酶中心PTC中空氨酰基位点的底物。MTRES1对肽基tRNA的结合和重新定位(比较图2C,D中的P-tRNA位置)将弹出E位点tRNA,并使异二聚体mtRF-R / MTRES1水解新生链并释放tRNA。RQC途径必须以少量的停滞核糖体为目标,同时保留大多数活性核糖体免受徒劳的营救。该途径特定于停滞和分裂的mtLSU,因为:i)正常翻译的核糖体很少存在空的A位点;ii)mtRF-R的α1-α2扭结排列会与小亚基在空间上发生冲突;iii)通过针对MTRES1(16S rRNA和肽基tRNA的有序螺旋69)包装来稳定mtRF-R,所有这些在空mtLSU中都不存在。

图2:线粒体翻译的核糖体相关质量控制途径。
对这一线粒体中核糖体的质量控制途径的结构分析和后续体外功能实验表明,mtRQC可以靶向降解异常多肽,以防止错误翻译折叠的蛋白导致疾病。此前的研究中,已经发现mtRF-R蛋白的截短突变体会直接导致神经相关的病理现象发生,包括视神经萎缩,周围神经病变和痉挛性轻瘫的三联征【3】,但是该蛋白的突变体为何以及如何导致疾病并无答案。现在,作者通过揭示该蛋白在调节线粒体翻译干扰中的重要性,提供了对这些疾病表型基础的理解。
在该工作中,由于纯化过程中引入了不可水解的GTP类似物GMPPCP,作者还成功捕捉到延伸循环中Decoding, Accommodation, Rotate-1, Post-translocation等不同状态的电镜结构,完整观察到线粒体中整个翻译延伸过程的核糖体构象变化(图三)。此外,基于纯化过程中去污剂和磷脂的运用,作者观察到线粒体核糖体与线粒体内膜转运蛋白Oxa1L复合物在延伸和相关质量控制途径中的不同阶段的结构,为核糖体翻译及其质量控制的拯救可以发生在线粒体内膜上提供了结构生物学证据。

图3:线粒体翻译的延伸循环。
当发现细胞使用翻译机制本身来检测错误并激活质量控制途径时,我们对翻译领域的认知模式发生了巨大的转变。尽管生物信息学基于与细菌和真核细胞胞质核糖体的类比,预测了线粒体翻译中存在可能的质量控制途径,但对其分子机制了解甚少。本文作者提供了第一个生化及结构生物学证据,发现的与线粒体翻译相关的质量控制途径(图2A)和延伸的线粒体核糖体的结构表征(图3),为进一步了解线粒体中核糖体的翻译调控奠定了基础。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652512866&idx=1&sn=88211090645d388f2866d759e9d69e99
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
线粒体靶向递送蛋白质新策略
1天同时发表4篇Cell Metabolism文章,中国学者在代谢领域取得新突破

北方是家鸡的驯化中心?线粒体DNA分析不支持
【综述】线粒体蛋白翻译后修饰在葡萄糖代谢中的作用
合肥研究院线粒体蛋白跨膜转运研究获进展
华中农大揭示蛋白去乙酰化酶调控核糖体蛋白的机制

【大师讲堂】小核核糖核蛋白的发现历程

Nat Comm:线粒体微蛋白调控内质网应激反应
mTORC2控制线粒体膜通透性,调节自噬流量并影响寿命长短
打破认知,核糖体蛋白参与植物细胞器内含子剪切