科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-12-11
来源:iNature
2020年11月9日,美国辉瑞(Pfizer)和德国BioNTech公司发布公告,表示三期临床试验的首批中期有效性分析显示,其mRNA疫苗BNT162b2在双盲试验中的有效性超过90%。此次试验有43538名参与者,目前尚未发现严重的安全问题。
2020年12月10日,由BioNTech和辉瑞赞助的BNT162b2三期临床试验正式在国际顶级医学期刊NEJM 发表题为”Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine“的研究论文,该研究发现BNT162b2的两剂方案可为16岁或以上的人群提供针对Covid-19的95%保护。BNT162b2的安全性特征在于注射部位的短期,轻度至中度疼痛,疲劳和头痛。严重不良事件的发生率较低,在疫苗和安慰剂组中相似。
不过,近期美国食品药品管理局称,四位接受辉瑞疫苗注射的第三期志愿者出现了贝尔氏麻痹症,即面瘫。食品药品管理局的报告称,尚无明确证据将疫苗与令人不适的医学状况联系起来。尽管如此,联邦监管机构还是建议“对贝尔麻痹病例进行监视,并向更大的人群中部署疫苗。”

2020年9月8日,美国辉瑞(Pfizer)和德国BioNTech公司等大量研究人员合作,在预印版平台bioRxiv 在线发表题为“A prefusion SARS-CoV-2 spike RNA vaccine is highly immunogenic and prevents lung infection in non-human primates”的研究论文,该研究发现BNT162b2疫苗在恒河猴模型中能够在疫苗接种55天后的攻毒实验中,成功防护新冠病毒的肺部感染。

BNT162b2是一种脂质纳米颗粒(LNP)配制的N1-甲基-伪尿苷(m1Ψ)核苷修饰的具有融合前构象的新冠病毒刺突mRNA(modRNA)疫苗候选物。在细胞中表达BNT162b2编码序列后,约有20%的刺突分子处于单RBD“上”,两RBD“下”状态。m1Ψ修饰修饰可抑制先天免疫感应,并与优化的非编码序列元件一起提高体内RNA 的翻译。
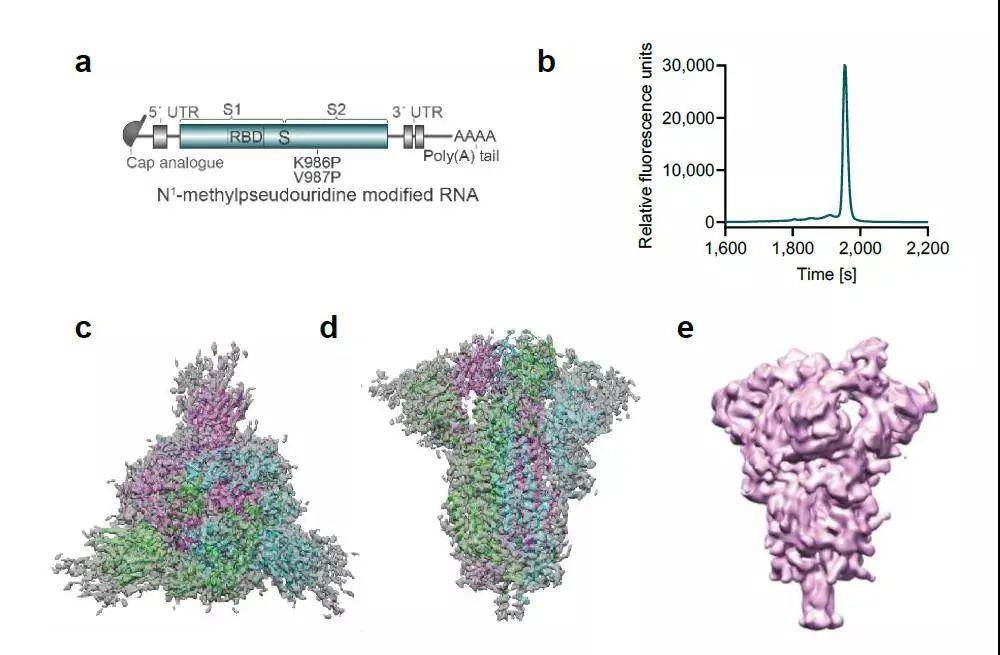
BNT162b2的设计方案
用单剂量的BNT162b2免疫小鼠后,伪病毒中和滴度呈现剂量依赖性增加。恒河猴的初免-加强疫苗接种引起了SARS-CoV-2中和的几何平均滴度为SARS-CoV-2恢复期人血清组的10.2至18.0倍。BNT162b2在小鼠和恒河猴中产生强TH1型CD4 +和IFNγ+ CD8 + T细胞反应。 BNT162b2候选疫苗可完全保护免疫恒河猴的肺免受传染性SARS-CoV-2攻击。
BNT162b2已在美国(NCT04368728)和德国(NCT04380701,EudraCT:2020 001038-36)的1期临床试验中进行了评估,目前正在关键的,全球的2/3期安全性和有效性研究中进行评估。

2020年10月14日,美国辉瑞(Pfizer)和德国BioNTech公司等大量研究人员合作,在国际顶级医学期刊NEJM 在线发表题为“Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates”的研究论文,该研究支持选择BNT162b2进行进一步的研究 到关键的2至3期安全性和有效性评估。
具体来说,总共195名参与者进行了随机分组。在每13组的15名参与者中,有12名参与者接受了疫苗,3名参与者接受了安慰剂。与BNT162b1相比,BNT162b2的全身反应发生率和严重性较低,尤其是在老年人中。在年轻人和老年人中,这两种疫苗候选物均引起相似的剂量依赖性SARS-CoV-2中和几何平均滴度,该滴度与一组SARS-CoV-2恢复期血清样品的几何平均滴度相似或更高。
来自美国的这项针对年轻人和老年人的两种候选疫苗的美国1期试验的安全性和免疫原性数据,再加上来自德国和美国的较年轻的成年人中有关BNT162b1的较早中期安全性和免疫原性数据,支持选择BNT162b2进行进一步的研究到关键的2至3期安全性和有效性评估。
2020年11月9日,美国辉瑞(Pfizer)和德国BioNTech公司发布公告,表示三期临床试验的首批中期有效性分析显示,其mRNA疫苗BNT162b2在双盲试验中的有效性超过90%。此次试验有43538名参与者,目前尚未发现严重的安全问题。两家公司预计将于下周向美国食品药品监管局申请紧急使用授权。

特朗普在推特上用英文大写字母发文,宣布一个“好消息”。他写道:“股市大涨,疫苗即将上市。报告90%有效。好消息!”
截至发稿,辉瑞股价暴涨15%,其市值增加300亿美元(折合1981亿人民币)。
不过,美国辉瑞(Pfizer)和德国BioNTech公司公布的数据不是很详细,具体的数据还需要看正式提交给美国FDA的报告。
2020年12月10日,由BioNTech和辉瑞赞助的BNT162b2三期临床试验正式在国际顶级医学期刊NEJM发表题为”Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine“的研究论文,该研究发现BNT162b2的两剂方案可为16岁或以上的人群提供针对Covid-19的95%保护。BNT162b2的安全性特征在于注射部位的短期,轻度至中度疼痛,疲劳和头痛。严重不良事件的发生率较低,在疫苗和安慰剂组中相似。
不过,近期美国食品药品管理局称,四位接受辉瑞疫苗注射的第三期志愿者出现了贝尔氏麻痹症,即面瘫。食品药品管理局的报告称,尚无明确证据将疫苗与令人不适的医学状况联系起来。尽管如此,联邦监管机构还是建议“对贝尔麻痹病例进行监视,并向更大的人群中部署疫苗。”
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247519128&idx=3&sn=f6cc48a1fe060e6099e02a1a211ba37b
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

新冠疫苗临床试验中的关键问题

中央深改委第四次会议,习近平:发挥国家发展规划的战略导向作用
【生活】特殊时期,宝宝接种疫苗要注意哪些问题?
【生活】特殊时期,宝宝接种疫苗要注意哪些问题?




卫生健康委解答百白破疫苗接种补种有关问题
不惧流感!科学家研发纳米颗粒疫苗对抗甲型流感病毒
专家释疑疫苗问题:勿因恐慌放弃 过期无毒

关于宫颈癌疫苗的五个问题

习近平对长春长生疫苗案作重要指示:一查到底 严肃问责

新疫苗可提高免疫细胞对抗流感能力