科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-12-15
来源:科学通报
本文发表于《科学通报》“亮点述评”栏目,由南方科技大学徐明华教授撰写,介绍香港科技大学孙建伟课题组、加州大学洛杉矶分校Kendall N. Houk课题组和香港城市大学朱光宇教授2020年12月14日发表于Nature Catalysis的研究成果。
合成化学的快速发展极大地推动和促进了生物医药、农药和材料等科学的创新和发展。2019年, 美国默克公司科学家在Science发表题为“The importance of synthetic chemistry in the pharmaceutical industry”的综述, 阐述了合成化学对制药工业的重要性[1]。有趣的是, 在对药物分子的化学形状空间结构的分析中[2], 阿斯利康的科学家发现绝大多数药物分子都是线性和圆盘形分子, 相比之下, 球形形状分子很少(图1(a)), 其中一个主要的原因是缺乏有效的合成方法。由于分子的功能和性质在很大程度上受其空间形状和构型的影响, 因此扩展化学形状空间, 研究化合物不同分子形状对药效的影响在药物研发中具有重要意义。
四芳基甲烷(CTAMs)是一类代表性的具有几何球形形状结构的分子, 被报道用于光电器件、功能材料、药物传递和蛋白质易位检测等多个领域的研究中。然而,该类分子的直接不对称合成并没有成功的报道(图1(b))[3]。香港科技大学孙建伟课题组、加州大学洛杉矶分校KendallN. Houk课题组和香港城市大学朱光宇教授合作, 在有机小分子催化研究领域取得突破性进展, 发展了一种催化不对称构建全芳基取代季碳的方法, 成功用于手性四芳基甲烷的合成, 该成果2020年12月14日在线发表在Nature Catalysis[4]。
手性四芳基甲烷的不对称合成极具挑战性, 一方面由于分子中4个芳基均与中心碳直接相连, 空间上非常拥挤, 需要克服较大的位阻影响, 高效构建相应的碳-碳键; 另一方面, 需要对四个相似的芳基进行有效的立体区分, 实现季碳手性中心的高选择性构建。为解决上述问题, 他们提出了手性离子对催化的策略, 如图1(c)所示, 以带有离去基团的外消旋三芳基甲烷1为底物, 在催化剂作用下生成三芳基甲基碳正离子中间体, 进而接受富电子芳烃2的亲核进攻便能得到相应的四芳基甲烷3。在进一步的设想中, 期望利用手性催化剂阴离子与相应的三芳基甲基阳离子共振中间体亚甲基醌(QM)形成手性离子对用于不对称诱导, 为实现反应的立体选择性控制, 设计在芳基中引入标记基团, 借助氢键弱相互作用引导和识别芳基间微小的区分[5]。
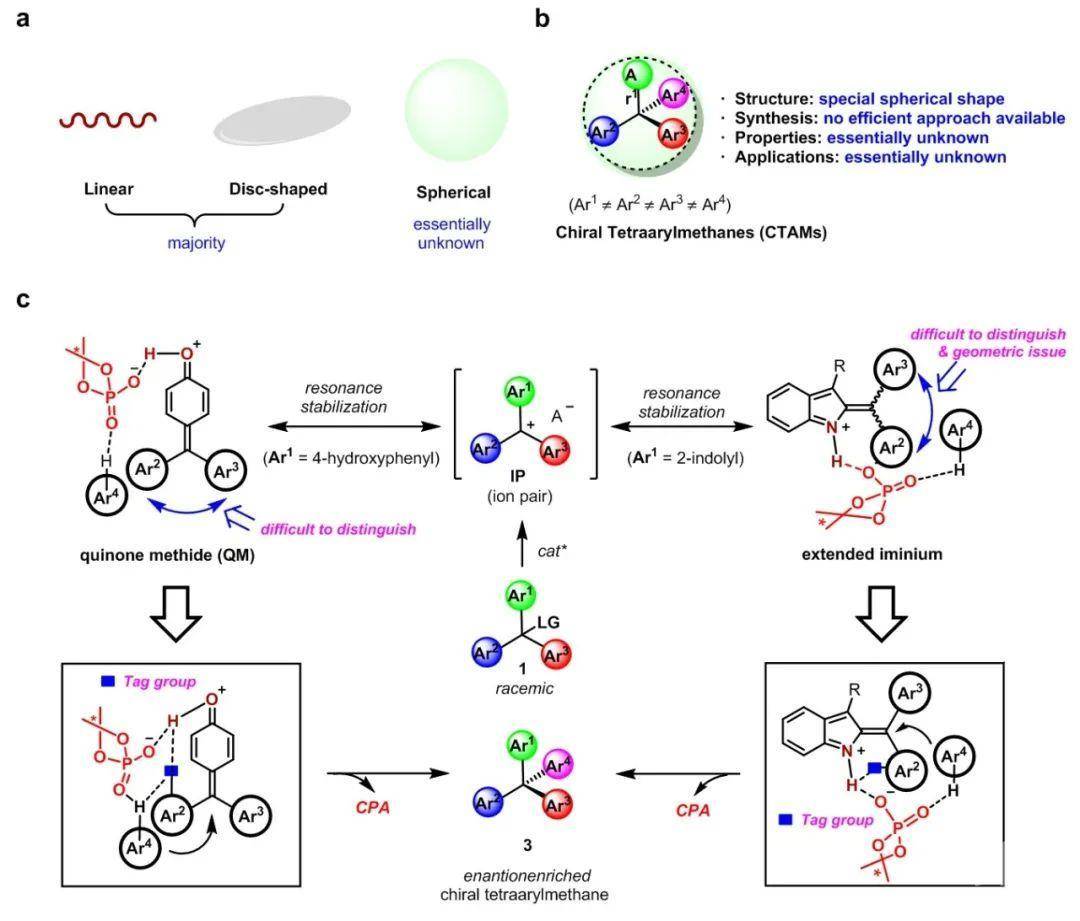
图1 催化不对称合成手性四芳基甲烷(CTAMs)的策略
基于上述思路和策略, 研究人员将底物分子中3个芳基中的2个进行不同的官能团标记, 分别是氢键供体(例如, OH)和氢键受体(例如, 烷氧基), 而且这些供电子基可以通过共振作用进一步限制中心碳碳键的旋转, 从而有利于立体选择性控制。确实, 当羟基与芳基相连时, 苄基碳正离子中间体可以进一步稳定为亚甲基醌(QM), 然后另一个标记提供二级氢键相互作用, 以提供关键的对映面选择性区分(图1(c))。利用该策略, 研究人员实现了手性磷酸催化下一系列手性四芳基甲烷的高对映选择性构建(图2)。其中, 除了邻位烷氧基以外, 二级氢键标记基团也可以是邻位羟基、磺酰氨基、硫醚、以及氟原子。其他取代的吡咯也可以作为亲核试剂取得很高的选择性和反应效率。另外, 吲哚结构广泛存在于天然产物和生物活性药物分子中, 是一类重要的杂环。如果利用吲哚作为一级标记芳环, 类似的苄基碳正离子中间体可以被稳定为共轭亚胺进而接受亲核进攻, 其不对称控制同样可以利用手性磷酸对亚胺的活化来实现。实验证明, 这种设想可以成功用于各种含有吲哚基的手性四芳基甲烷的高效立体选择性构建[6]。
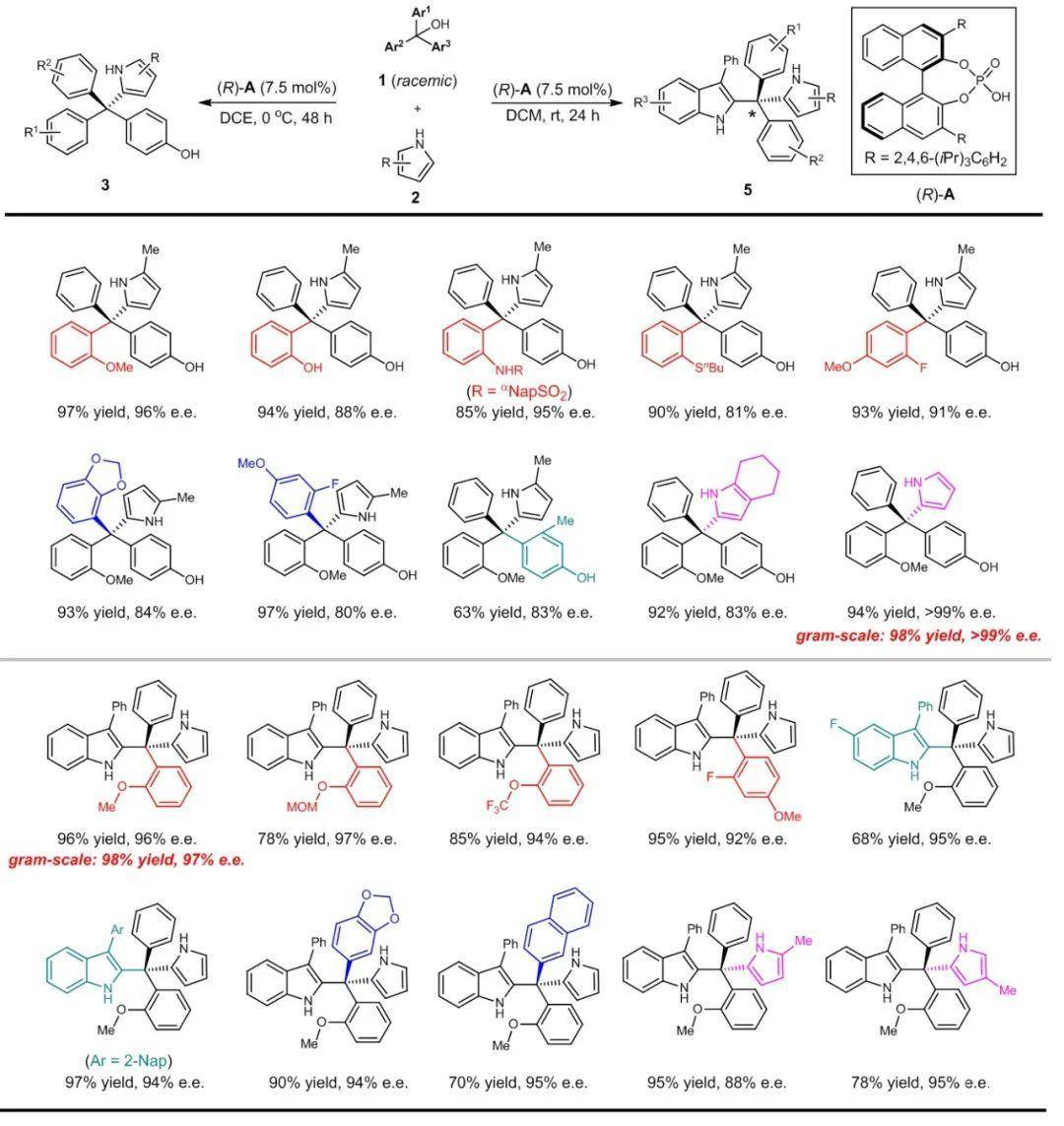
图2 对映选择性合成手性四芳基甲烷
研究人员基于实验结果, 通过密度泛函理论(DFT)计算, 对反应机理进行了研究。以4-苯酚取代的三芳基甲醇与2-甲基吡咯的反应作为模板, 计算结果表明, 该反应的手性决定步骤是吡咯亲核进攻QM中间体, 而反应的决速步骤是酸催化脱水过程。此外, 初步的生物活性实验结果表明, 一些化合物具有良好的抗肿瘤活性。
孙建伟课题组、Kendall N. Houk课题组及朱光宇教授, 利用手性磷酸催化实现了手性四芳基甲烷的对映选择性合成。通过引入双官能团标记氢键控制策略, 有效地解决了立体选择性控制方面的难题。机理研究和DFT计算表明, 手性磷酸与原位生成的亚甲基醌或亚胺中间体和标记基团的弱氢键相互作用是成功的关键。初步的生物活性实验结果表明, 这些全新结构的手性球形分子有望用于新药研发, 为药物分子的化学形状空间多样性研究提供有用的参考。
参考文献
1 CamposK R, Coleman P J, Alvarez J C, et al. The importance of synthetic chemistry inthe pharmaceutical industry. Science, 2019, 363: eaat0805
2 BrownD G, Boström J. Analysis of past and present synthetic methodologies onmedicinal chemistry: where have all the new reactions gone? J Med Chem, 2016, 59: 4443-4458
3 Tsuchida K, Senda Y, Nakajima K, et al. Construction of chiral tri- andtetra-arylmethanes bearing quaternary carbon centers: Copper-catalyzedenantioselective propargylation of indoles with propargylic esters. Angew Chem Int Ed, 2016, 55: 9728-9732
4 Li X, Duan M, Deng Z, et al. Catalytic enantioselectivesynthesis of chiral tetraarylmethanes. Nat Catal, 2020, doi: 10.1038/s41929-020-00535-4
5 Doyle A G, Jacobsen E N. Small-molecule H-bond donors in asymmetric catalysis. Chem Rev, 2007, 107: 5713-5743
6 Zhang H H, Wang C S, Li C, et al. Design and enantioselectiveconstruction of axially chiral naphthyl-indole skeletons. Angew Chem Int Ed, 2017, 56: 116-121
来源:kexuetongbao 科学通报
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3ODgxMzc1Ng==&mid=2650449437&idx=1&sn=5ca04fc573f4f9813e74230a5a3099d7
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn