科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-12-22
来源:材料科学与工程
乳腺癌是一种复杂的异质性疾病,在女性中发病率和死亡率最高,三阴性乳腺癌(TNBC)被认为是一种高度恶性的乳腺癌。光动力疗法(PDT)作为一种依赖于光活性染料的疗法,可以与免疫疗法和化学疗法等其他治疗方法相结合,产生针对恶性肿瘤(如乳腺癌)的增强的抗肿瘤功效。然而,目前的困境是,光活性剂未能通过化学修饰可控地调节它们的光转化,以优化肿瘤治疗和预后。
苏州大学陈华兵教授团队提出,超分子纳米结构中光活性剂的非共价相互作用,和重原子调节的相互作用,可能共同提供有效的亚细胞级联传递和内在抗肿瘤活性。相关论文以题为“Heavy-Atom-Modulated Supramolecular Assembly Increases Antitumor Potencyagainst Malignant Breast Tumors via Tunable Cooperativity”发表在ADVANCED MATERIALS上。

研究结果发现,多碘化硼二吡咯甲基胶束产生可调的光,然后转化为单线态氧和热效应,以及肿瘤处的深度渗透和随后的细胞质易位。四碘化硼二吡咯甲基胶束(4-IBMs)通过大量凋亡蛋白的表达,有效抑制皮下和原位TNBC模型,以及降低氧依赖性,特别显示出明显增强的抗肿瘤效率的协同性。此外,与化疗和手术切除相比,4-IBMs产生了更好的抗转移和抗复发功效。
通过π-π堆积和疏水相互作用产生的自组装的多碘化硼二吡咯甲基胶束(IBMs),引起了向细胞质的有效级联传递和向单线态氧的可调光转换以及热效应,产生了对TNBC有利的PDT /PTT协同作用(图1A)。根据透射电子显微镜成像(图1B),这些IBMs显示出平均大小的球形胶束形态为24.5 ± 8.2, 20.3 ±5.8, 和26.1 ± 7.3 nm。连同平均流体动力直径为45.6, 34.2, 和 50.6 nm(图1C)。
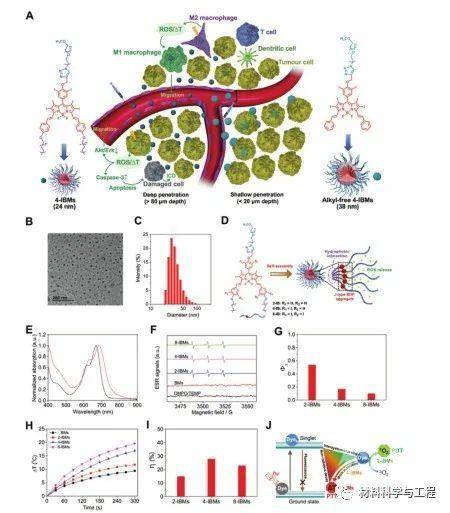
图1 IBMs的制备和表征。A)4-IBMs的超分子组装、肿瘤靶向递送和光疗机制的示意图。B)4-IBMs的TEM成像。B) 4-IBMs的尺寸分布。D)双、四或八碘化BDP衍生物(2-IB、4-IB和8-IB)通过π-π堆积和疏水相互作用自组装成具有J型聚集体的胶束。E)4-IBMs在水和二甲基甲酰胺中的归一化吸收光谱。F)BMs、2-IBMs、4-IBMs和8-IBMs分别在0.5W·cm-2的660 nm光照下的电子自旋共振光谱。G)在660 nm光照射下,单线态氧量子产率分别为2-IBMs、4-IBMs和8-IBMs。H)浓度为20.0×106M的BMs、2-IBMs、4-IBMs和8-IBMs在660纳米光照射(0.5 W· cm-2)下的温度升高。I) 2-IBMs、4- IBMs和8-IBMs在0.5 W· cm-2在660纳米曝光下的光热转换效率。J)重原子调制的IBMs通过系统间交叉和非辐射衰变以及受抑制的辐射跃迁光转化为单线态氧和热生成路径的示意图。
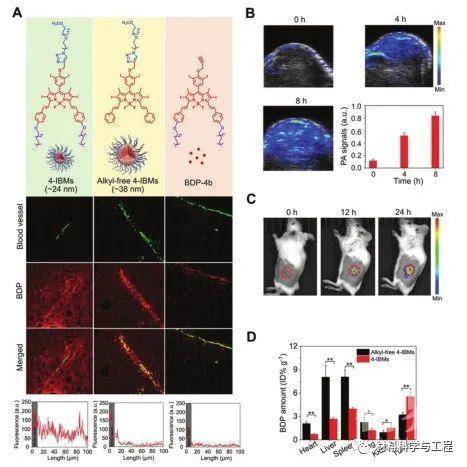
图2 肿瘤中4-IBMs的体内靶向递送。A)在注射后24小时,在小鼠的4T1肿瘤切片中的4-IBMs的免疫荧光成像,及其从血管(绿色)到深层肿瘤组织的相应荧光强度。B)在注射后0、4和8小时,以4.0 mol·kg-1的剂量,在4T1荷瘤小鼠的肿瘤部位的4-IBMs的体内光声图像,以及相应的光声强度。C)在注射后0、12和24小时,以4.0 mol·kg-1的剂量在小鼠的4T1肿瘤处对4-IBMs进行体内荧光成像。D)4-IBMs和不含烷基的4-IBMs在4T1荷瘤小鼠中的生物分布,注射后24小时,剂量为4.0mol·kg-1。
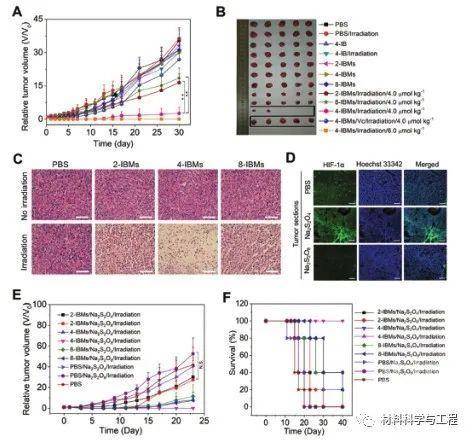
图3 IBMs对皮下4T1肿瘤模型的协同光疗。A)在有或没有Vc的情况下,以4.0或6.0 mol·kg-1的剂量用2-IBMs、4-IBMs、4-IBMs和8-IBMs处理的小鼠的肿瘤生长曲线,在660纳米的光照下,以0.5 W·cm-2照射5分钟。b)实验结束时的肿瘤照片。c)照射后6小时,从用剂量为4.0摩尔/千克-1的2-IBMs、4- IBMs和8- IBMs治疗的小鼠中采集的H&E染色肿瘤切片图像。D )分别通过瘤内注射由浓度为5.0×10-3 M的50.0 uLNa2S2O4和Na2S2O8溶液,引起的小鼠缺氧和氧化的4T1肿瘤中的HIF-1α水平。F) 如(E)所示,在注射后40天内,用2-IBMs、4-IBMs和8-IBMs治疗的缺氧和氧化4T1肿瘤小鼠的存活率。
总的来说,研究人员展示了重原子调节超分子的自组装纳米结构,这些超分子被有效地输送到细胞质中,用于原位、转移性和复发性TNBC病的协同光疗。该研究将为实现协同癌症治疗提供新的机会,并为精确纳米医学提供一种有洞察力的方法。
来源:mse_material 材料科学与工程
原文链接:http://mp.weixin.qq.com/s?__biz=MzA4NDk3ODEwNQ==&mid=2698835584&idx=2&sn=f8f476b7c9696e2952d484223e352fe1
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
【纳米】基于铂纳米颗粒的电动力疗法用于有效癌症治疗
研究进展:治疗癌症多功能生物分子纳米结构
第22届全国肿瘤防治宣传周启动仪式在北京举行




纳米尺度上的分子吸附
中国抗癌协会王瑛秘书长出席河北省肿瘤防治宣传周启动仪式



中国抗癌协会整合肿瘤学分会成立大会在西安召开




2D纳米片治疗癌症
用于癌症治疗的智能纳米药物
【纳米】Angew. Chem.:大共轭碳纳米管片段构建“分子皇冠”超分子异质结

iNKT细胞在癌症中的纳米诱导器 | 《自然-癌症》