科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-01-06
来源:DeepTech深科技
自最早的基因编辑工具问世至今,基因编辑技术已经有近 30 年的历史了。特别是 2012 年以来,随着 CRISPR 的横空出世,基因编辑技术日渐趋于成熟。然而遗憾的是,相对于基因编辑工具本身的快速进化,其递送技术的发展极其缓慢和困难。而递送之于基因编辑治疗的重要性如同火箭之于登月。由于递送技术的滞后发展,体内基因编辑治疗的临床应用困难重重,整个领域都在期待递送技术的突破。
诺奖得主 Jennifer Doudna 在 2020 年初给 Nature 杂志撰写的综述中,系统论述了基因编辑治疗的前景和挑战。在展望 CRISPR 美好应用前景的同时,这位今年的诺奖得主发出了“递送可能仍然是基因编辑体细胞治疗的最大瓶颈”的感叹(Delivery remains perhaps the biggest bottleneck to somatic-cell genome editing)。

近几年来,基因编辑工具本身的发展令人眼花缭乱,各种 Cas9 变体、碱基编辑工具及其变体、Prime Editor 等,层出不穷。但是,这些工具的临床应用必须回归到递送,而迄今为止可选的递送工具还是有几十年历史的‘“老三件”:AAV、慢病毒以及纳米材料。尽管这些递送载体广泛用于基础研究,但它们却不太适合直接用于临床。基因编辑的临床应用有着安全性和有效性的双重标准。一方面,病毒载体由于长时间的表达基因编辑酶,会带来安全性上的不确定性;另一方面,纳米材料则面临效率上的挑战。2020 年上半年,张峰作为创始人的著名基因编辑治疗科技型企业 Editas 实施了首例人体基因编辑治疗的临床研究 (Nature Biotechnology volume 38, page 382 (2020))。但由于该研究使用 AAV 作为载体,CRISPR 将长期与患者共存,具有一定的风险。理想的基因编辑递送工具需要兼具瞬时和高效的特点,以确保治疗的安全性和有效性。
近日,上海交通大学系统生物医学研究院的蔡宇伽团队在《自然 - 生物医学工程》(Nature Biomedical Engineering)杂志上发表了一篇题为:Lentiviral delivery of co-packaged Cas9 mRNA and a Vegfa-targeting guide RNA prevents wet age-related macular degeneration in mice 的研究论文,发明了一种介于病毒载体与非病毒载体之间的类病毒体(virus-like particle, VLP)递送技术。VLP 可以递送 CRISPR/Cas9 mRNA, 实现安全和高效的体内基因编辑。值得一提的是,该技术是我国首个完全自主开发的原创型基因治疗载体,体现了我国在基因治疗领域的科技进步。

“实现基因编辑酶在体内的瞬时递送是我们基因治疗科学家的终极梦想。有了这样的载体,我们可以最大限度地提高基因编辑治疗的安全性,也意味着基因编辑体内治疗离临床应用无限接近。然而,实现这个梦想并不容易,也几乎没有人相信可以成功。我从博士生时代开始尝试, 到现在成为博士生的导师,经过 10 年时间的不断地探索与积累,直到最近才取得了核心突破。”蔡宇伽博士说。
慢病毒载体可以高效感染几乎所有的细胞,而非病毒成分 mRNA 具有瞬时性的特点。蔡宇伽团队利用 mRNA 茎环结构与噬菌体衣壳蛋白特异识别的原理,通过病毒工程技术,将两者的优点完美的结合起来,创造了新型递送技术 VLP-mRNA。通过 VLP-mRNA 递送 Cas9 mRNA, Cas9 的存在时间只有 72 小时。研究发现,与长时间表达 Cas9 的病毒系统相比,VLP-mRNA 可以显著降低、甚至完全避免脱靶效应。另外,VLP-mRNA 可以递送整个 CRISPR 元件(Cas9 与 gRNA), 克服了 AAV 载体运载能力小的限制,甚至可以递送更大的碱基编辑工具。
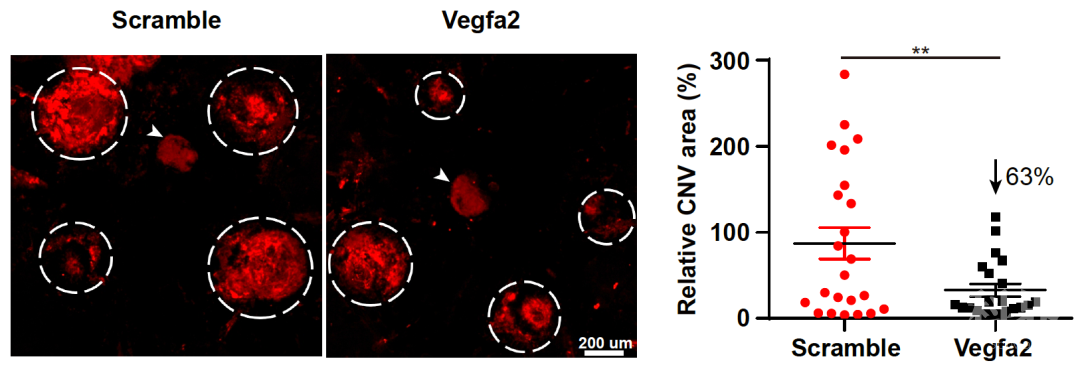
研究人员还将 VLP-mRNA 技术用于眼科疾病的治疗。老年性黄斑变性(AMD)是一种退行性眼底疾病。患者表现为中心视力下降、视物变形、周边部或中心视野出现暗点,对老年人的生活质量造成极大的影响。据统计,西方发达国家中 70 岁以上的老年人罹患 AMD 者超过 40%。随着我国老年人口日渐增多,黄斑变性的发病率也越来越高。另外,糖尿病患者也可能罹糖尿病相关黄斑变性,总体发病率在 10% 左右。目前,黄斑变性的治疗方法是 VEGF 单克隆抗体。然而,抗体需要反复给药;另外,抗体外溢可导致严重的副反应。
研究团队利用激光诱导的小鼠黄斑变性模型,通过视网膜下腔注射的方式,发现 CRISPR 特异性的分布在视网膜色素上皮细胞(RPE),而 RPE 细胞是眼内 VEGF 的主要来源。VLP 递送 CRISPR 实现了高达 44% 的 vegfa 基因敲除,降低了 63% 的新生血管面积。第二代测序表明 VLP-mRNA 未诱导出脱靶效应。对于此前报道的 AAV 递送 CRISPR 引起的大片段缺失,研究团队通过第三代测序,仅能发现勉强高于背景的信号。值得一提的是,VLP mRNA 无论在体外还是在眼内,均未引起免疫反应。这些实验结果有力支持了 CRISPR 在黄斑变性基因治疗上的临床应用潜力。
总结
总的来说,VLP-mRNA 是一种通用型的、瞬时性的 CRISPR 递送工具,兼具高效和安全的优点。该技术无疑将帮助 CRISPR 体内基因编辑治疗时代的真正来临,为无药可治或有药难治的遗传性、获得性以及感染性疾病的患者带来新的希望。
上海交通大学博士生凌思凯是本文的第一作者,上海交通大学附属第一人民医院眼科临床医学中心的杨仕琪博士、孙晓东教授也为本研究的完成做出了重要贡献。复旦大学附属眼耳鼻喉科医院、瑞金医院、中科院、丹麦奥胡斯大学的科学家参与了本研究。
来源:deeptechchina DeepTech深科技
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3NTIyODUzNA==&mid=2649612695&idx=4&sn=13289a45d51bbb627f6691b67dae18be
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
《自然》发文:麻省理工学院发现海洋中一种未知病毒
新型武器:Crispr技术将成新冠病毒的“克星”

你身体里也有病毒基因:存在于众多生命中

中国腺病毒载体疫苗:研发竞赛全球领跑

艾滋病疫苗为何“难产”?
基于CRISPR的新冠病毒快速诊断技术出现

病毒,不单单是“祸害”

武汉病毒所在I型单纯疱疹病毒载体构建研究中取得进展

小心!手机也可能是病毒载体!
宇宙可能到处都是外星病毒,或成发现外星人首个迹象