科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-01-08
来源:植物生物学
实验原理
染色质免疫共沉淀技术(Chromatin Immunoprecipitation, ChIP)是在活细胞状态下将蛋白质-DNA复合物稳定, 并将DNA随机切断为一定长度范围内的片段, 再利用免疫学方法特异性富集目的蛋白, 从而获得与目的蛋白相结合的DNA (Jackson, 1978; Collas, 2010)。对于获得的DNA, 可以进一步与其它实验技术(如定量PCR (Singal et al., 2002)和DNA印迹杂交(Orlando et al., 1997))相结合进行深入分析, 以验证预计与目的蛋白在相同复合体内的DNA序列是否确实存在。免疫共沉淀技术与高通量测序技术结合, 可以对组蛋白修饰和转录因子在全基因组范围内的分布进行客观、无预期检测(Weinmann et al., 2001; Das et al., 2004)。目前, 染色质免疫共沉淀技术已广泛应用于检测各类转录因子以及组蛋白结合位点的体内定位(Collas, 2010)。
染色质免疫共沉淀通常包括2种类型: 交联免疫共沉淀(cross-linked ChIP, X-ChIP)和无交联免疫共沉淀(native ChIP, N-ChIP)。X-ChIP一般采用甲醛作为可逆的交联剂, 通过超声波将染色质破碎为200–500 bp的片段; 免疫沉淀后, 将蛋白质-DNA复合体解交联, 蛋白质可通过蛋白酶进行降解, 然后纯化提取DNA (Orlando, 2000; Wells and Farnham, 2002)。由于甲醛固定增强了DNA与蛋白质的结合程度, 降低了蛋白质重排的可能性, 因此X-ChIP的灵敏度较高, 适用于转录因子等与DNA结合程度不是很强的蛋白质研究。N-ChIP是利用核酸酶消化未经固定的染色质, 由于未经固定的蛋白质-DNA复合体保持在自然状态, 因此N-ChIP适用于与DNA结合紧密的组蛋白修饰的表观遗传学研究; 同时, 由于抗体与未固定的目标蛋白质结合程度高, 因此N-ChIP的特异性较强, DNA富集效率高(O’Neill and Turner, 2003; Thorne et al., 2004)。
通常情况下, X-ChIP实验需要106–107个细胞(Mikkelsen et al., 2007; Barski et al., 2007), 至少需要103–106个细胞。此外, 交联在一定程度上会影响后续检测的质量(Adli et al., 2010; Hitchler and Rice, 2011)。基于微球菌核酸酶非交联免疫共沉淀(Ultra-Low-Input micrococcal nuclease-based Native ChIP, ULI-NChIP)适用于微量实验材料, 可以从103个细胞起始构建高质量测序文库, 适用于组蛋白修饰情况研究(Brind’Amour et al., 2015)。目前, ULI-NChIP技术已应用于植物研究(Wang et al., 2017)。
本文以模式植物拟南芥(Arabidopsis thaliana)为实验材料, 介绍了常规的交联染色质免疫共沉淀以及适用于微量样品的ULI-NChIP实验方法和注意事项。
1 实验材料拟南芥(Arabidopsis thaliana L.)组织。
2 试剂蛋白酶抑制剂(Roche, CatNo.04693132001), 在使用前加入。
苯甲基磺酰氟(Phenylmethylsulfonylfluoride, PMSF, Sigma-Aldrich, Cat No.P7626), 在使用前加入。
Protein A Dynabeads (Life Technologies, Cat No.1006D)。
Protein G Dynabeads (Life Technologies, Cat No.1007D)。
RNase A (Roche, CatNo.11119915001)。
蛋白酶K (Life Technologies, Cat No.25530049)。
核提取缓冲液(Sigma-Aldrich, Cat No.NUC101)。
微球菌核酸酶(Micrococcal nuclease, MNase)、MNase缓冲液(NEB, Cat No.M2047)。
固相萃取柱(Qiagen, Cat No.129046)。
线性聚丙烯酰胺(Sigma-Aldrich, Cat No.56575)。
神奇滤布(Millipore, CatNo.475855)。
3 试剂配方M1缓冲液: 10 mmol·L–1磷酸缓冲液(pH7.2), 0.1 mol·L–1 NaCl, 10 mmol·L–1 β-巯基乙醇, 1 mol·L–1戊二醇,0.1 mmol·L–1 PMSF, 1×蛋白酶抑制剂, 现配现用。
M2缓冲液: 10 mmol·L–1磷酸缓冲液(pH7.2), 0.1 mol·L–1 NaCl, 10 mmol·L–1 β-巯基乙醇, 1 mol·L–1 戊二醇, 10 mmol·L–1 MgCl2, 0.5% Triton X-100, 0.1 mmol·L–1 PMSF, 1×蛋白酶抑制剂, 现配现用。
M3缓冲液: 10 mmol·L–1磷酸缓冲液(pH7.2), 0.1 mol·L–1 NaCl, 10 mmol·L–1 β-巯基乙醇, 0.1 mmol·L–1 PMSF, 1×蛋白酶抑制剂, 现配现用。
核裂解缓冲液: 50 mmol·L–1 Tris-HCl (pH8.0), 10 mmol·L–1 EDTA, 1% SDS, 0.1 mmol·L–1 PMSF, 2×蛋白酶抑制剂, 现配现用。
ChIP稀释缓冲液: 1.1% TritonX-100, 1.2 mmol·L–1 EDTA, 16.7 mmol·L–1 Tris-HCl (pH8.0), 167 mmol·L–1 NaCl, 0.1 mmol·L–1 PMSF, 1×蛋白酶抑制剂。
低盐缓冲液: 150 mmol·L–1 NaCl, 0.1% SDS, 1% Triton X-100, 2 mmol·L–1 EDTA, 20 mmol·L–1 Tris-HCl (pH8.0)。
高盐缓冲液: 500 mmol·L–1 NaCl, 0.1% SDS, 1% Triton X-100, 2 mmol·L–1 EDTA, 20 mmol·L–1 Tris-HCl (pH8.0)。
氯化锂缓冲液: 0.25 mol·L–1 LiCl, 1%脱氧胆酸钠, 1 mmol·L–1 EDTA, 10 mmol·L–1 Tris-HCl (pH8.0)。
TE缓冲液: 1 mmol·L–1 EDTA, 10 mmol·L–1 Tris-HCl (pH8.0)。
ChIP洗脱缓冲液: 100 mmol·L–1 NaHCO3,1% SDS。
洗脱缓冲液: 10 mmol·L–1 Tris-HCl (pH8.0)。
蛋白水解缓冲液(每个样品31.5 μL): 20 μL 1 mol·L–1 Tris-HCl (pH6.8), 10 μL 0.5 mol·L–1 EDTA, 1.5 μL 20 mg·mL–1蛋白酶K。
Galbraith缓冲液: 45 mmol·L–1 MgCl2, 30 mmol·L–1柠檬酸钠, 20 mmol·L–1 MES (pH7.0), 现用现配。
MNase稀释缓冲液: 10 mmol·L–1 Tris-HCl (pH7.5), 10 mmol·L–1 NaCl, 1 mmol·L–1 EDTA, 50%甘油。
ChIP缓冲液: 20 mmol·L–1 Tris-HCl (pH8.0), 2 mmol·L–1 EDTA, 150 mmol·L–1 NaCl, 0.1% Triton X-100, 1×蛋白酶抑制剂, 1 mmol·L–1 PMSF。
4 仪器设备旋转摇床: Labquake, Thermo Scientific。
离心机: 5418R或5810R, Eppendorf。
超声破碎仪: Bioruptor, Diagenode。
磁力架: DynaMag-2, Life Technologies。
4°C冷室。
凝胶电泳仪。
5 实验程序5.1 实验流程
具体实验流程见图1。
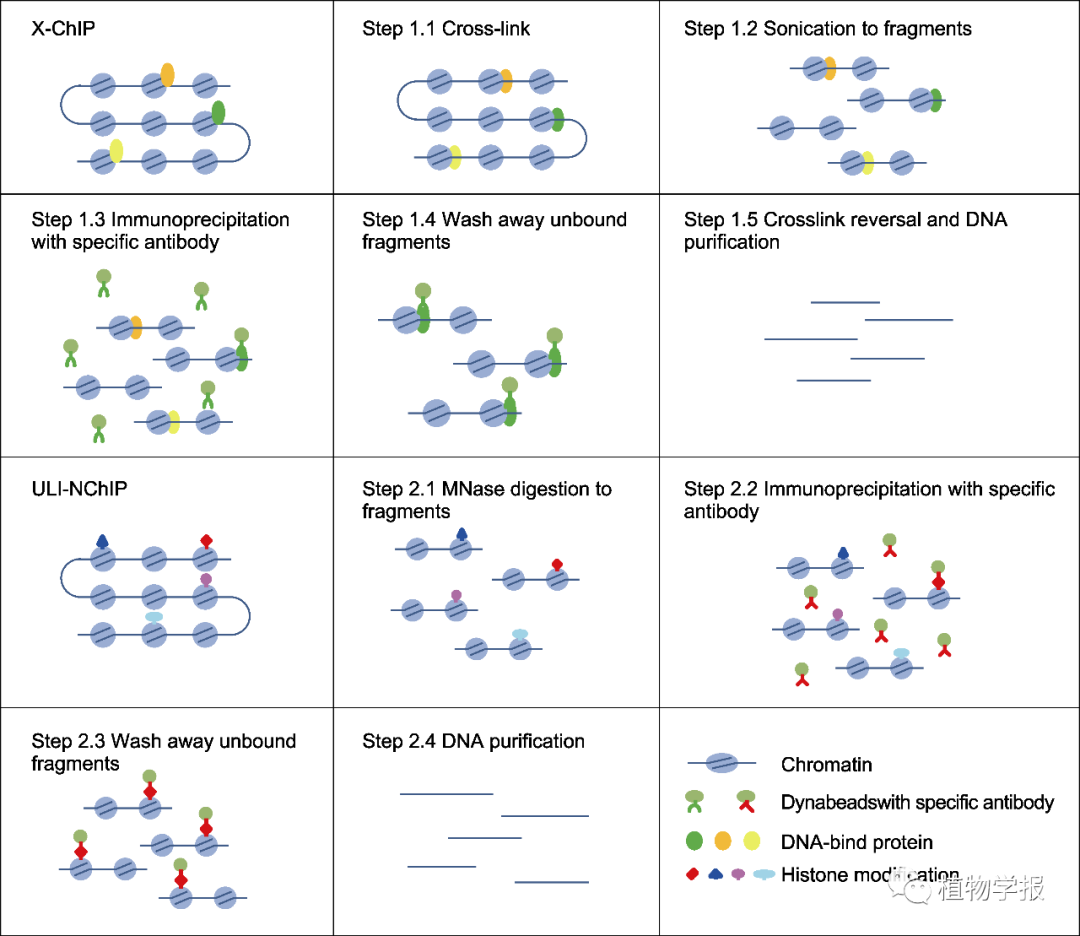
图1 交联免疫共沉淀(X-ChIP)与基于微球菌核酸酶非交联免疫共沉淀(ULI-NChIP)实验流程图
5.2 交联染色质免疫共沉淀5.2.1 染色质制备
(1) 取约1 g实验材料, 在液氮中将材料充分研磨, 加入预冷后装有35 mL M1缓冲液的50 mL离心管中涡旋振荡混匀。
(2) 加入972 μL 37%甲醛(终浓度1%), 4°C缓慢旋转孵育10分钟。固定时间可以根据样品特性适当调整。
(3) 加入2.4 mL 2 mol·L–1甘氨酸溶液(终浓度为0.125 mol·L–1)终止交联反应, 4°C缓慢旋转孵育10分钟。
(4) 准备4层神奇滤布, 用双蒸水润洗后将溶液过滤至新的50 mL离心管中。4°C下1 000 ×g离心20分钟, 弃上清。
(5) 用20 mL M2缓冲液重悬沉淀, 注意用移液枪缓慢吹吸避免产生气泡。4°C下1 000 ×g离心20分钟, 弃上清。
(6) 重复以上步骤, 用M2缓冲液再洗1次。
(7) 用8 mL M3缓冲液重悬沉淀, 4°C下1 000 ×g离心10分钟, 用移液枪尽量去除上清。
(8) 加1 mL核裂解缓冲液重悬沉淀, 转移至2个1.5 mL离心管中。
(9) 用超声破碎仪打断DNA, 初次使用时, 需要摸索超声条件, 可以取1 μL 5.2.3节(5)中DNA纯化后的产物进行凝胶电泳, 要求弥散带在200 bp–1 kb之间, 集中富集在200–500 bp。参考超声破碎条件: 强度选择为高, 30秒/ON, 30秒/OFF, 6个循环, 重复2次。
(10) 4°C下16 000 ×g离心15分钟, 合并两管上清(约1 mL)至新1.5 mL离心管中。
(11) 取100 μL作为给料对照(input)置于–20°C冰箱暂存。
(12) 剩余样品用ChIP稀释缓冲液稀释3–5倍。
5.2.2 免疫沉淀
(1) 取100 μL Protein A/G Dynabeads, 加1 mL ChIP稀释缓冲液清洗3次后, 用100 μL ChIP稀释缓冲液重悬磁珠, 加入取出给料对照的样品(稀释后)中, 于4°C缓慢旋转, 预杂交染色质1小时。
(2) 将样品置于磁力架上, 转移上清至新的离心管中, 加入1 μg抗体, 于4°C缓慢旋转, 孵育过夜。
(3) 加入100 μL用同样方法清洗后的磁珠, 4°C缓慢旋转孵育1小时。
(4) 将样品置于磁力架上, 弃上清, 依次加入1 mL低盐缓冲液、高盐缓冲液、氯化锂缓冲液、TE缓冲液清洗磁珠, 每次清洗均于4°C缓慢旋转5分钟。
(5) 清洗结束后, 用移液枪尽量吸去上清, 加入250 μL ChIP洗脱缓冲液。
(6) 取出给料对照, 加入150 μL ChIP洗脱缓冲液, 总体积为250 μL, 与实验组样品同时进行后续步骤。
(7) 将样品和给料对照分别于65°C孵育15分钟, 然后将样品置于磁力架上, 转移上清至新的离心管中。
(8) 分别加入250 μL ChIP洗脱缓冲液, 重复洗脱1次, 将2次洗脱液合并, 体积约为500 μL。
(9) 在洗脱液中分别加入20 μL 5 mol·L–1 NaCl, 65°C解交联至少6小时, 解交联后可置于–20°C冰箱暂存。
5.2.3 DNA纯化
(1) 取出样品放至室温。每管加入31.5 μL蛋白水解缓冲液, 45°C孵育1小时。加入20 μg RNase A, 37°C孵育30分钟。
(2) 加入等体积苯酚、氯仿、异戊醇混合物(25:24:1, v/v/v)抽提, 16 000 ×g离心5分钟。
(3) 取上清液, 按照1:100体积比加入20 mg·mL–1糖原助沉剂, 混匀, 然后按照1:10体积比加入3 mol·L–1 NaAc (pH5.2), 混匀, 最后加入1 mL无水乙醇, –20°C沉淀3小时。
(4) 4°C下16 000 ×g离心20分钟。用70%乙醇洗涤2次。
(5) 弃上清, 待乙醇完全挥发后, 加入100 μL双蒸水, 充分混匀, 即为目的DNA。
5.3 ULI-NChIP5.3.1 染色质制备
(1) 取约10 mg实验材料于1.5 mL离心管中, 加入30 μL Galbraith缓冲液, 于冰上充分研磨, 再用20 μL Galbraith缓冲液冲洗研磨棒, 合并混合后约50 μL。4°C下1 000 ×g离心10分钟, 弃上清。
(2) 加入50 μL核提取缓冲液重悬沉淀。
(3) 取0.5 μL MNase, 加入4.5 μL MNase稀释缓冲液稀释至200 U·μL–1。需要注意的是, MNase对温度十分敏感, 建议将酶分装保存, 并且在初次使用时检测酶切割效率, 可以取1 μL 5.3.3节(5)中DNA纯化后的产物进行凝胶电泳检测, 弥散带应集中富集在200–500 bp。
(4) 加入6 μL MNase缓冲液, 0.88 μL 0.1 mol·L–1 DTT, 2.5 μL双蒸水, 0.6 μL稀释后的200 U·μL–1 MNase, 用枪头吹打至充分混匀。37°C孵育7.5分钟。
(5) 加入6.6 μL 100 mmol·L–1 EDTA, 用枪头吹打至充分混匀, 终止反应。
(6) 加入6.6 μL 1% Triton X-100/1%脱氧胆酸钠, 充分混匀, 冰上静置15分钟后涡旋振荡30秒。
(7) 加入227 μL ChIP缓冲液, 4°C缓慢旋转1小时。
(8) 涡旋振荡30秒后, 取30 μL作为给料对照, 加入3 μL 10% SDS, 充分混匀, 加入67 μL洗脱缓冲液, 置于–20°C冰箱暂存。
5.3.2 免疫沉淀
(1) 取10 μL Protein A/G Dynabeads, 加1 mL ChIP缓冲液清洗3次后用10 μL ChIP缓冲液重悬磁珠, 然后加入取出给料对照后的样品中, 于4°C缓慢旋转, 预杂交染色质至少2小时。
(2) 取10 μL Protein A/G Dynabeads, 同样清洗3次后, 加入200 μL ChIP缓冲液重悬磁珠, 然后加入1 μg抗体, 于4°C缓慢旋转, 孵育至少3小时。
(3) 将样品置于磁力架上, 弃掉步骤(2)的上清, 取步骤(1)的上清加入步骤(2)的磁珠中, 于4°C缓慢旋转, 孵育过夜。
(4) 用磁力架吸附磁珠, 弃上清。加入200 μL低盐缓冲液, 用枪头吹打几次清洗磁珠, 重复清洗1次。再用200 μL高盐缓冲液清洗2次。
(5) 尽量吸去上清, 加入30 μL ChIP洗脱缓冲液, 65°C孵育1.5小时, 取上清。加入70 μL洗脱缓冲液清洗磁珠, 将2次上清液合并, 体积约为100 μL。
(6) 取出给料对照, 与实验组样品同时进行后续步骤。
5.3.3 DNA纯化
(1) 将洗脱下来的液体转移至固相萃取柱; 同时取出给料对照, 转移至另一个固相萃取柱。
(2) 在2个样品中分别加入100 μL苯酚、氯仿、异戊醇混合液(25:24:1, v/v/v), 剧烈涡旋振荡30秒, 16 000 ×g离心5分钟。
(3) 将上清液转移至新的1.5 mL离心管中, 加入10 μL 3 mol·L–1 NaAc, 1 μL线性聚丙烯酰胺, 充分混匀后, 加入275 μL预冷的无水乙醇, 充分混匀后于–20°C沉淀2–3小时。
(4) 4°C下16 000 ×g离心30分钟。弃上清, 加入200 μL现配的70%乙醇清洗沉淀。
(5) 弃上清, 待乙醇完全挥发后, 加入20 μL洗脱缓冲液, 充分混匀, 即为目的DNA。
5.4 纯化后分析对于纯化后的DNA, 可以通过与其它实验结合进行深入分析。若研究特定目的基因的结合情况, 可以采用定量PCR, 以给料对照作为参照, 设置合适的PCR体系及程序, 分析DNA的富集程度; 若结合二代测序技术进行ChIP-seq, 可以参考DNA文库构建试剂盒(NEB, Cat No.E7645)进行建库、测序并分析DNA结合情况。
6 注意事项(1) 交联。甲醛是最常用的交联剂(Orlando et al., 1997), 其优点在于形成的交联可逆, 但是需要注意交联时间, 过度的交联会导致超声波难以破碎, 也有可能造成蛋白质与DNA的间接结合。同时, 甲醛固定后消化酶不能再进行消化(Johnson and Bresnick, 2002)。
(2) 染色质切割。无论是X-ChIP还是N-ChIP, 染色质切割都是关键的一步。在使用超声破碎时, 需要摸索破碎条件, 使得染色质断裂的片段分布在200–500 bp之间。影响超声破碎的因素包括样品体积、超声探头深度、超声强度以及超声时间(Spencer et al., 2003)。超声时要保持在4°C。在利用核酸酶进行消化时, 必须严格控制不同样品的消化时间, 过度消化会导致亚核体的形成, 从而阻碍DNA-蛋白质相互作用的检测。
(3) 抗体。抗体是决定实验成败的重要因素, 因此必须选择IP级别的抗体, 同时要考虑单抗与多抗的选择。单抗的特异性强, 但是识别位点单一, 若靶蛋白被其它蛋白或核酸结合会导致该位点被封闭而不能识别。要根据抗体选择对应的Protein A或者G的磁珠。
(4) 操作。实验全程温度尽量保持在4°C, 操作过程中避免起泡。
(5) 结果分析。染色质免疫共沉淀得到DNA片段未必说明抗体识别的目的蛋白能够直接结合DNA。与目的蛋白形成复合体的其它蛋白如果与DNA结合, 也可能富集DNA。

来源:PlantBiotech 植物生物学
原文链接:http://mp.weixin.qq.com/s?__biz=MzI5NTk2MTcyOA==&mid=2247494654&idx=3&sn=067b5d542de2cd2017c9da6e0a54d600
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
活细胞蛋白质标记与成像研究获进展

一种研究活细胞内蛋白质互作的新方法

自然中不存在的蛋白质也能人造了!撼动材料医药界
蛋白质纤维
乳清蛋白质
球状蛋白质
蛋白质浓度测定

蛋白质工程
蛋白质分析技术
铁氧反应为科学家提供了肺癌治疗新思路