科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-01-26
来源:药学进展
最新科研成果速递
2021年1月21日,清华大学药学院尹航教授团队在《细胞发现》(Cell Discovery)杂志上在线发表了题为“新冠病毒的衣壳蛋白通过其N端内在无序区发生相变进入应激颗粒”(SARS-CoV-2 nucleocapsid protein undergoes liquid–liquid phase separation into stress granules through its N-terminal intrinsically disordered region)的通讯文章 [1]。
研究背景:
新冠病毒衣壳蛋白(N)干扰机制
与液液相分离
2019年底,新冠疾病爆发,随后肆虐全球。截止2021年1月24日,新冠病毒已造成超过9700万人感染,引起200多万人的死亡,是当今最令人关注的公共卫生问题之一 [2]。新冠病毒(SARS-CoV-2)是正义单链RNA病毒,其衣壳蛋白(N)具有稳定病毒RNA;调控病毒基因组的复制、转录、翻译和包装的作用 [3]。尽管衣壳蛋白的部分结构已经得到解析,然而衣壳蛋白干扰细胞正常生理过程的分子机制尚不明确。
液液相分离是生物大分子,例如蛋白、核酸等聚集浓缩形成类似液滴结构的过程。病毒感染过程中,液液相分离能为病毒提供复制场所,促进病毒机器的组装。之前的研究表明,冠状病毒能够诱导细胞内应激颗粒的组装,应激颗粒的形成会引起宿主细胞的全局翻译沉默。
研究过程:
通过N端内在无序区
和G3BP1蛋白发生相分离
2021年1月21日,清华大学药学院尹航教授团队在《细胞发现》(Cell Discovery)杂志上在线发表了题为“新冠病毒的衣壳蛋白通过其N端内在无序区发生相变进入应激颗粒”的通讯文章 [1]。研究发现新冠病毒的N蛋白能够通过N端内在无序区和G3BP1蛋白发生相分离。
01 预测可能介导相分离区域
首先,为了分析新冠病毒N蛋白相分离的能力,研究者通过在线工具预测到可能介导相分离的N端无序区。进一步地,在模拟细胞受病毒感染的应激状态下,N蛋白聚集形成微米级别的液滴,缺失该无序区抑制了液滴的形成。研究者还通过延时摄影、荧光淬灭后回复(FRAP)等手段证明了N蛋白形成的液滴具有相分离液滴的流动性。
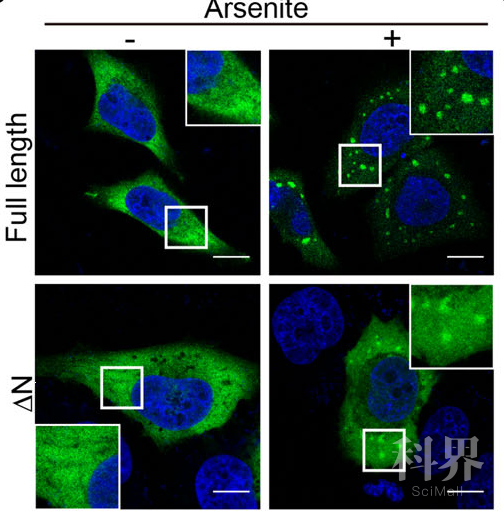
图1 新冠病毒N蛋白在应激压力下在细胞内发生相分离
02 探究N蛋白发生相变因素
随后,研究者深入探究了N蛋白发生相变的因素,发现N蛋白会进入应激颗粒中,依赖于应激颗粒中的关键蛋白G3BP1。利用shRNA敲低G3BP1蛋白后,显著抑制了N蛋白的聚集和液滴的产生。同时,N蛋白进入应激颗粒需要自身的N端无序区。
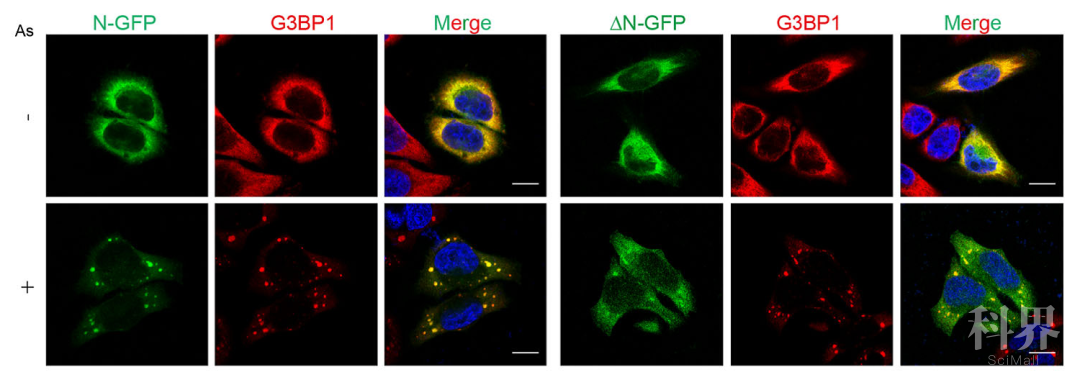
图 2 新冠病毒N蛋白进入应激颗粒,依赖于N端无序区
03 体外纯化蛋白重构相分离过程
最后,研究者通过在体外纯化相应的蛋白,重构了新冠病毒N蛋白的液液相分离过程,显示新冠病毒N蛋白的相分离受到RNA的调控。
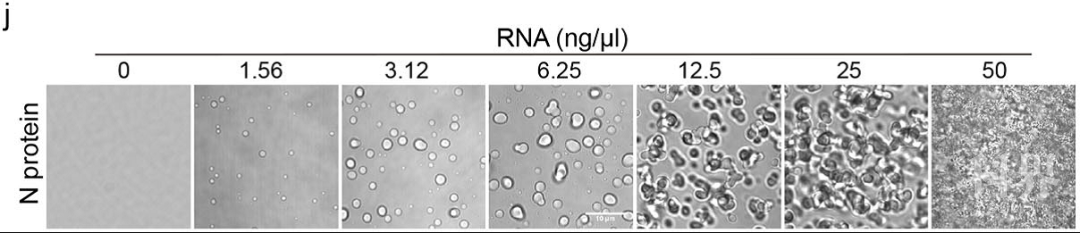
图3 新冠病毒N蛋白的体外相分离受到RNA的调控
此项研究揭示了新冠病毒相分离的新机制,新冠病毒N蛋白通过G3BP蛋白相分离进入应激颗粒可能是病毒抑制宿主细胞天然免疫的一种策略。该研究为研发特效的抗击新冠病毒的药物提供了潜在的靶点和方向。
文章的通讯作者是清华大学药学院尹航教授,共同第一作者为清华大学药学院博士后王佳和博士后施成瑞。
本研究得到了国家自然科学基金、科技部重点研发项目、北京市卓越青年科学家项目、清华大学“春风”基金的大力支持,实验得到清华大学尼康生物影像中心的协助。
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5MDY3ODExNQ==&mid=2651316349&idx=3&sn=82f70616a4a86035cff5961668b1b779
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

人体细胞中发现抗埃博拉病毒蛋白

首个新冠病毒3C蛋白酶药物高通量检测细胞体系问世
一个小小的细胞就有多达4200万个蛋白质分子

艾滋病疫苗为何“难产”?

你身体里也有病毒基因:存在于众多生命中

今日科技话题:冠状病毒s蛋白、狂犬病毒、光催化、新冠重症患者、“热木星”、饿死癌细胞

我国首个P4实验室正式运行,致力于最危险病毒研究

评论:“坏兔子”病毒闹心,怎样才能将网络恶棍拦在门外

病毒,不单单是“祸害”
武汉病毒所建立研究活细胞内蛋白质互作的新方法

