科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-02-05
内容来源:中国科学院重大科技基础设施共享服务平台
2021年1月29日,国际学术期刊Angewandte Chemie-International Edition在线发表了国家蛋白质科学研究(上海)设施用户四川大学生物治疗国家重点实验室杨胜勇课题组的研究论文 “Structure-guided Discovery of a Potent and Selective Cell-active Inhibitor of SETDB1 Tudor Domain”,该研究报道了首个具有细胞活性的选择性SETDB1 Tudor结构域抑制剂。
表观遗传调控异常与肿瘤、免疫性疾病等重大疾病以及多种罕见病密切相关。阅读器(Reader)蛋白作为一类重要的表观遗传调控蛋白,识别并参与组蛋白的翻译后修饰,在调节基因表达和信号转导中起着重要作用。在“Reader”蛋白中,识别乙酰化修饰的溴域(bromodomain)蛋白已被广泛研究,其中部分溴域蛋白例如BET家族的BRD4,已有大量小分子抑制剂报道,并已有分子进入临床试验。而其它“Reader”蛋白则研究较少,还特别缺乏特异性小分子抑制剂。
SETDB1是一种重要的H3K9甲基化修饰蛋白,可以促进某些肿瘤抑制基因的沉默,并在肺癌、黑色素瘤、肝癌、乳腺癌等癌症中异常表达。SETDB1是一种多域蛋白,其中串联Tudor结构域(TTD)的主要功能是识别H3K9甲基化(K9me(1/2/3))和K14乙酰化(K14ac)双修饰的组蛋白H3,但其具体的生物学功能和调控机制尚不清楚,另外目前还没有高活性和选择性抑制剂报道。研发靶向SETDB1-TTD的小分子化合物不仅有助于探索其生物学功能,也可能成为相关疾病治疗的先导化合物。
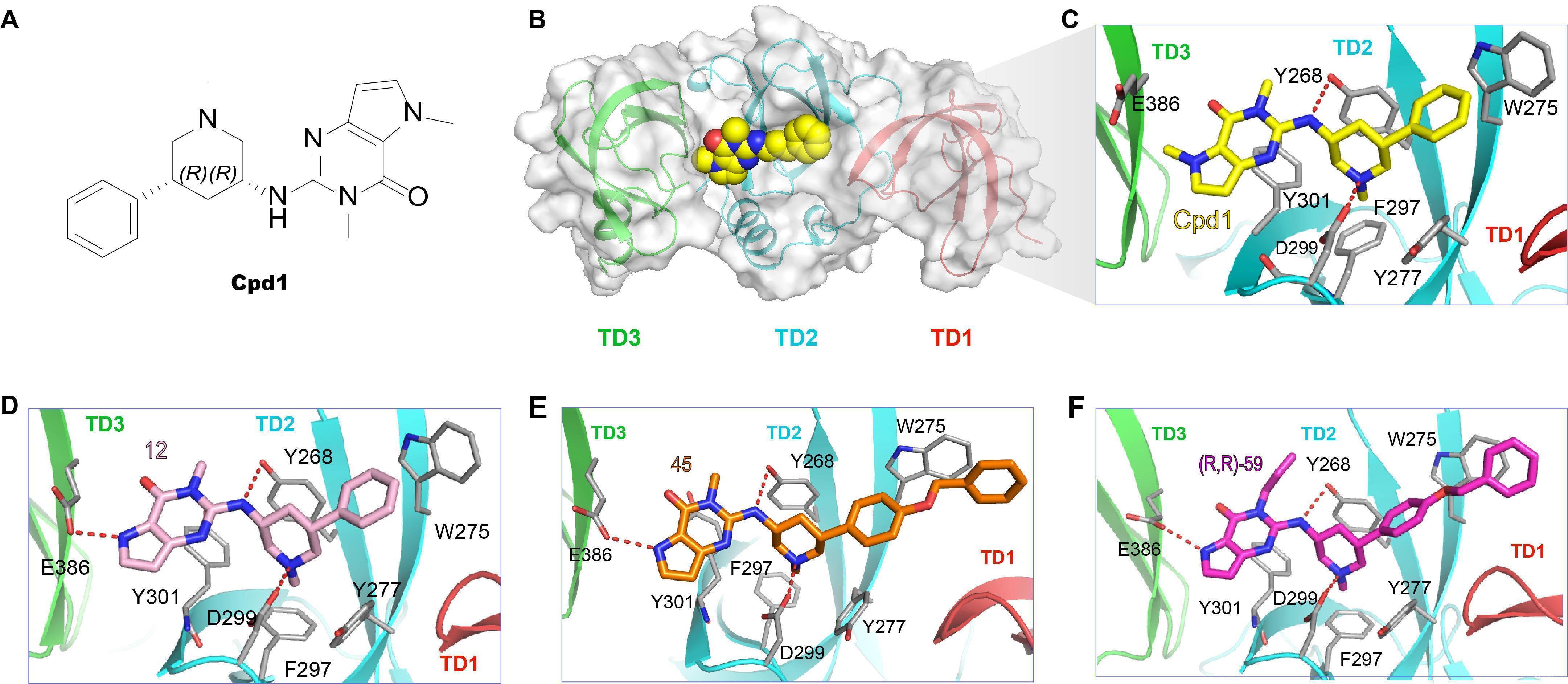
图1 SETDB1-TTD与Cpd1及其改构化合物的复合物晶体结构
四川大学杨胜勇教授团队首先通过多种筛选方法发现了一个苗头化合物(Cpd1),并成功解析了SETDB1-TTD与Cpd1复合物的晶体结构。基于该复合物晶体结构,通过多步的结构优化设计、化学合成、生物学活性测试、复合物晶体结构确证等,最终发现了一个高活性的SETDB1-TTD小分子抑制剂(R,R)-59(KD = 88 nM)。选择性测试表明,(R,R)-59对测试的16种Tudor结构域蛋白、32种溴域蛋白均无活性或活性很差,表明(R,R)-59对SETDB1-TTD具有良好的选择性。进一步的生物学实验证明,(R,R)-59可以有效阻断SETDB1-TTD与H3K9me(1/2/3)K14ac的结合,表明(R,R)-59是内源性底物的竞争性抑制剂。该团队采用细胞内热转移测试(cellular thermal shift assay, CETSA) 和荧光漂白恢复(fluorescence recovery after photobleaching, FRAP)等实验证明(R,R)-59可以在细胞内有效靶向SETDB1-TTD。有趣的是,该化合物的对映异构体(S,S)-59在所有测定中均未显示活性,提示(R,R)-59可作为工具化合物用于探索SETDB1-TTD的生物学功能。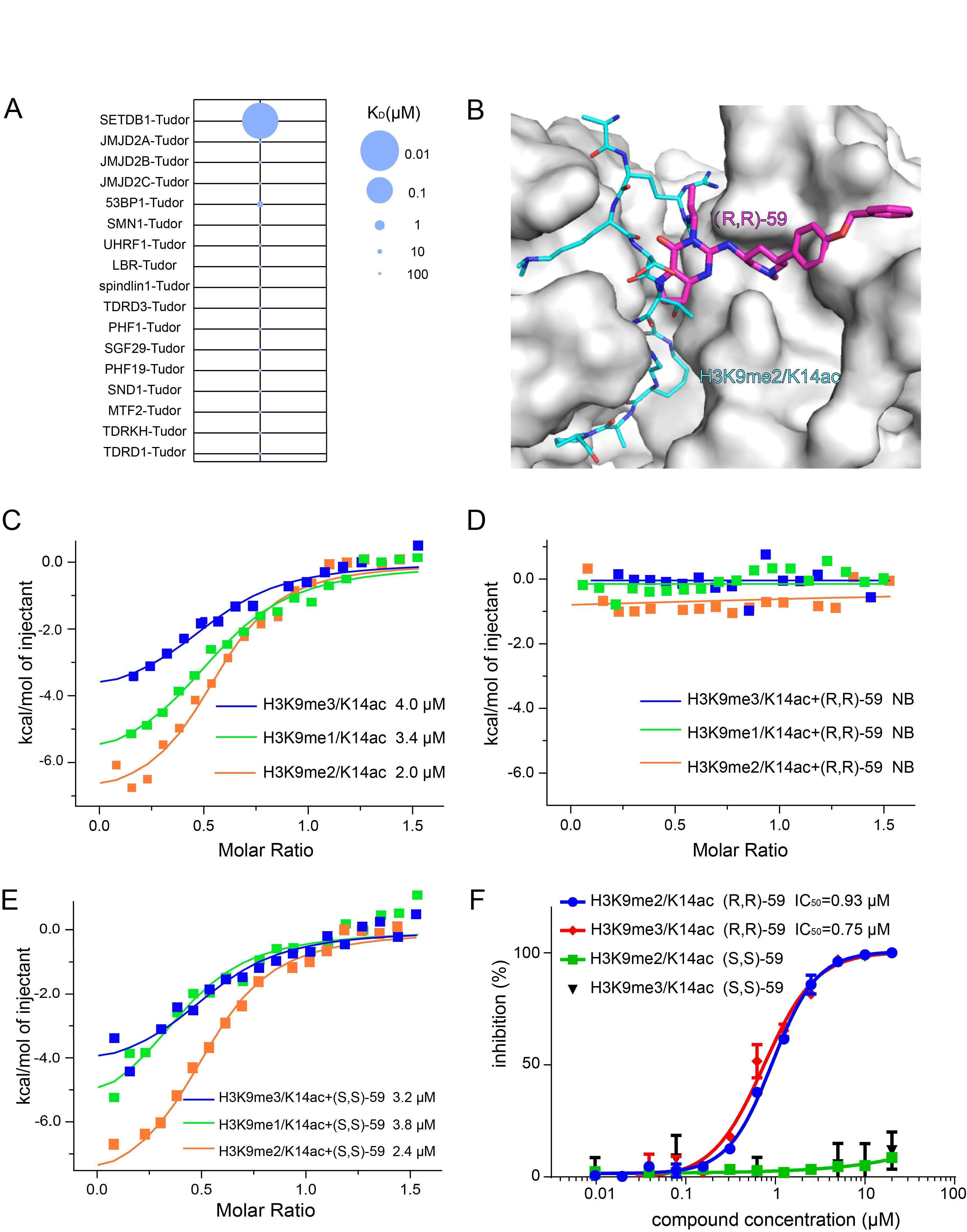 图2 (R,R)-59对Tudor结构域的选择性及其竞争性抑制SETDB1-TTD内源性底物
图2 (R,R)-59对Tudor结构域的选择性及其竞争性抑制SETDB1-TTD内源性底物 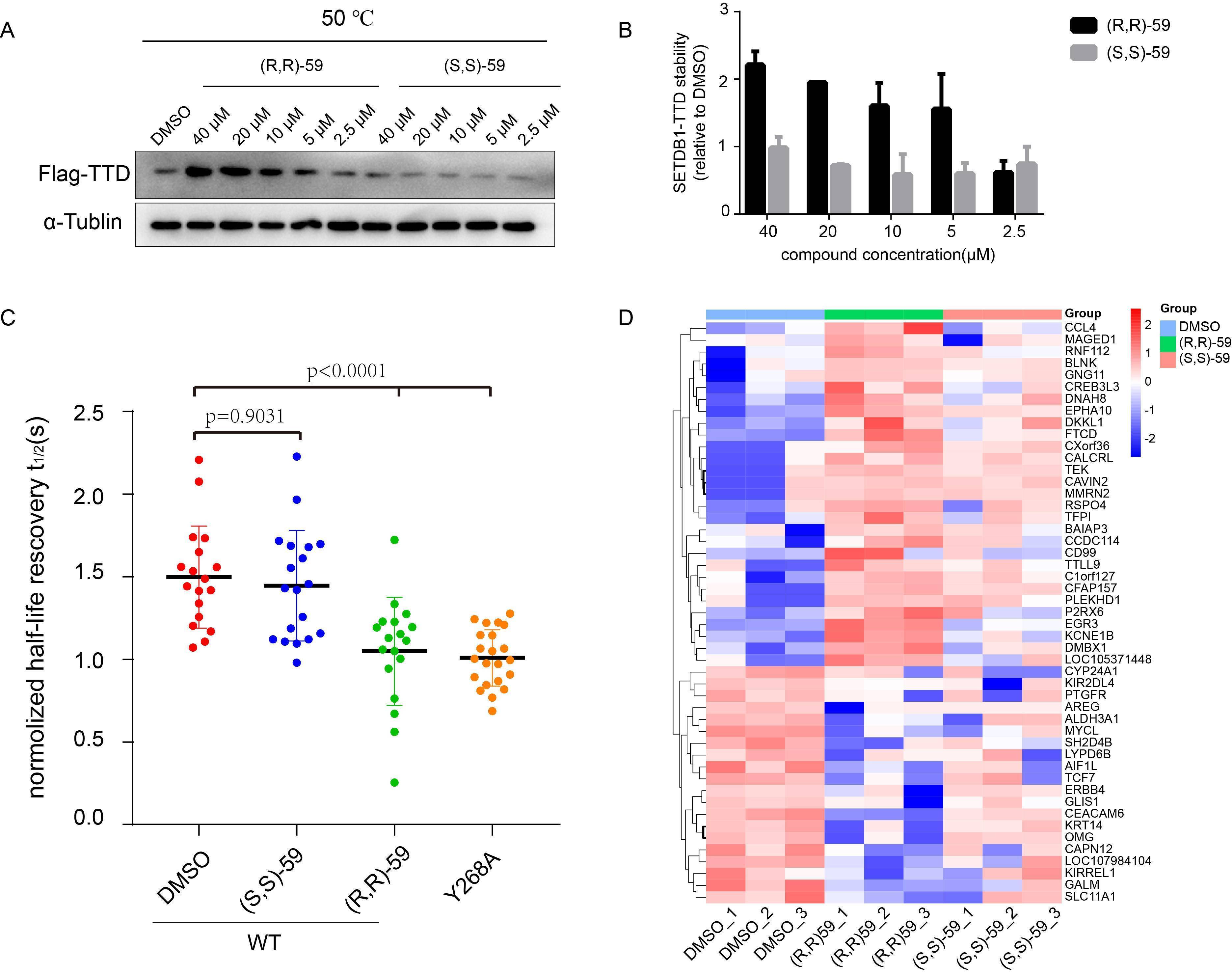 图3 化合物(R,R)-59在细胞内靶向SETDB1-TTD及影响相关基因的表达
图3 化合物(R,R)-59在细胞内靶向SETDB1-TTD及影响相关基因的表达
总之,该团队采用基于结构的药物设计和筛选、X射线晶体学、化学合成等方法,发现了首个高活性、选择性的SETDB1-TTD小分子抑制剂,并证明了该化合物可以有效靶向细胞内的SETDB1 TTD蛋白。该研究为探索SETDB1-TTD的生物学功能提供了一个有效的探针分子。
国家蛋白质科学研究(上海)设施BL18U1线站及BL19U1线站,上海光源BL17U1线站工作人员为其X射线晶体学衍射数据收集提供了及时有效的支持。
原文链接:http://lssf.cas.cn/lssf/dbzkxyjshss/xwdt/202102/t20210205_4560801.html
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
碱性胚胎蛋白
王英典教授课题组闻可心、陈毅星在知名杂志上发表论文
蛋白色
脑脊液蛋白电泳
蛋白S抗原
低蛋白饮食
Cell:细胞表面蛋白与蛋白相互作用图谱
脑脊液蛋白定量
血清α1-抗胰蛋白酶蛋白
唾液黏蛋白