科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-22
来源:中国高科技
原标题:Cell Reports:高福院士团队深度解析H7N9亚型禽流感病毒血凝素蛋白的跨种传播机制
A型流感病毒(Influenza A virus,IAV)属于正黏病毒科,是一个有囊膜的、分节段的单股负链的RNA病毒[1]。它是一种重要的人畜共患病原,在历史上曾引起多次流感大流行事件以及散发性禽流感病毒(Avian influenza virus,AIV)感染人事件,严重威胁公共卫生安全和社会经济发展。流感病毒表面有两个重要的囊膜蛋白——血凝素蛋白(Hemagglutinin,HA)和神经氨酸酶(Neuraminidase,NA)。不同亚型流感病毒与受体的结合主要是靠HA蛋白实现的,HA与受体的结合具有种属特异性。
HA与受体的结合是流感病毒感染的第一步,因此HA受体结合偏好性的转变是流感病毒跨种传播的关键决定因素。根据前人在流感病毒跨种传播领域的成果[2],目前已知不同亚型流感病毒HA分子跨种传播的分子机制有所差别【图1】。就H1亚型IAV而言,主要是由190和225位氨基酸起决定作用,在禽中分离的病毒主要是E190/G225,具有双受体结合特性,而在人中分离到的病毒主要是D190/D225,特异性结合人源受体。就H2和H3亚型IAV而言,主要由226和228位氨基酸决定,将Q226/G228突变成L226/S228即可使HA转变成人源受体结合偏好性。而在H5亚型IAV中,主要是226位氨基酸由谷氨酰胺(Glutamine,Q)到亮氨酸(Leucine,L)的转变以及158位糖基化的丢失等因素共同决定的。
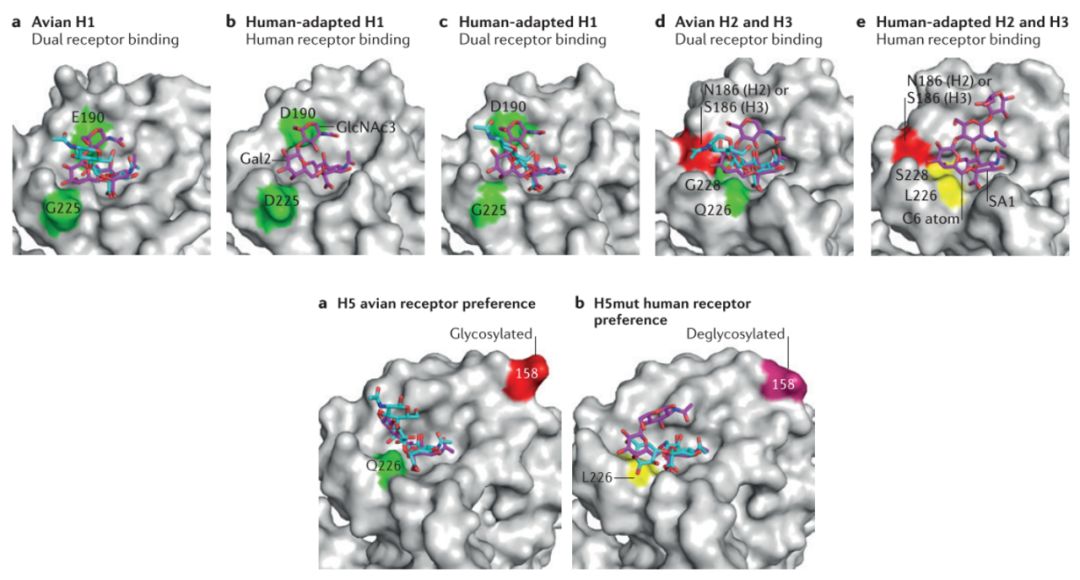
图1 不同亚型流感病毒HA的跨种传播分子基础[2]
自2013年起,H7N9亚型禽流感病毒已引起1600多人感染,并于2017年出现一些高致病性禽流感毒株。然而到目前为止,H7亚型与受体结合的关键分子基础尚未被完全阐明,各个氨基酸在其中所起的作用以及病毒获得人源受体结合特性的演化过程也仍不清楚。2019年11月19日,中国科学院微生物研究所高福院士团队在Cell Reports杂志上发表了题为“Avian-to-Human Receptor-Binding Adaption of Avian H7N9 Influenza VirusHemagglutinin”的研究论文[4],详细地阐述了H7N9亚型禽流感病毒血凝素蛋白由禽源受体偏好性向双受体结合特性演化的过程,该项成果对流感病毒防控工作具有重要指导意义。
研究人员通过序列分析、PCR定点突变、表面等离子共振技术、免疫荧光染色技术、反向遗传学技术以及结构生物学等技术,分析带有不同氨基酸组合的HA突变体的受体结合特性、病毒复制能力及结构等性质的变化,从分子层面详尽地阐明了H7N9亚型HA的跨种传播机制。他们发现仅186位氨基酸由甘氨酸(Glycine,G)变成缬氨酸(Valine,V),即可使禽受体结合特异性的SH1-H7N9 HA获得人源受体结合能力。而L226在其他三个位点存在亲水氨基酸时,是不利于人源受体和禽源受体的结合。基于结构分析,186位氨基酸的侧链可影响190-helix上E190侧链的走向,从而影响HA与受体的相互作用,而L226在没有其它三个疏水氨基酸(A138,V186和P221)搭配的情况下会降低220-loop的稳定性,从而降低HA对于人源和禽源两种受体的亲和力。
生化实验和结构分析结构表明,186位氨基酸是决定H7N9 HA获得人源受体结合能力的关键;而226位并非关键位点。当L226与亲水氨基酸搭配时,对两种受体结合都是有不利影响的,因此推测在演化上,很可能需要186位氨基酸先发生变化,而后发生Q226L的突变。通过分析所有H7亚型流感病毒的HA序列的进化关系,研究人员发现天然毒株中也存在这样的演化趋势。
总体而言,在H7N9亚型流感病毒HA在演化过程中,它首先由禽特异性结合的G186Q226变成双受体结合特性的V186Q226,最后演变成V186L226【图2】。其中186位氨基酸是H7N9 HA获得人源受体结合能力的关键氨基酸位点;而226位并非关键位点,在搭配亲水氨基酸时,反而不利于两种受体的结合。该项成果整合了生物化学、分子生物学、病毒学、生物信息学以及结构生物学等方法,阐明了H7N9亚型禽流感病毒的跨种传播机制及其独特的演化途径,从分子层面阐明H7N9 禽流感病毒的进化可能是由受体结合特性以及其它可能因素共同选择的结果。这些研究有利于深入理解H7亚型禽流感病毒跨种传播的分子机制,对于流感病毒疫情的预防与控制具有重要指导作用。
图2 H7N9 HA受体结合特性演化模式图[3]
据悉,中国科学技术大学徐颖博士为论文第一作者,中国科学院微生物研究所高福院士为论文通讯作者。另外,中国科学院微生物研究所的施一研究员、齐建勋研究员、张蔚副研究员、彭如超助理研究员等人在课题设计等方面给与了大量支持和帮助。
1.Dowdle, W.R., et al., Orthomyxoviridae. Intervirology, 1975. 5(5): p. 245-51.
2. Shi, Y., et al., Enabling the 'host jump': structuraldeterminants of receptor-binding specificity in influenza A viruses. NatRev Microbiol, 2014. 12(12): p.822-31.
3. Xu Y., et al.,Avian-to-Human Receptor-Binding Adaption of Avian H7N9 Influenza VirusHemagglutinin. Cell Reports, 2019.https://doi.org/10.1016/j.celrep.2019.10.047.
来源:cas-hitech 中国高科技
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MDczMTAzMA==&mid=2650047777&idx=2&sn=47df8117f72cc48b8a3c42a0f99ec3cc&chksm=87387158b04ff84ea6c0fa714130bd87da115e4c63826b8d0fa63901783f78479da8508a33e4&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

关注 | 《流行性感冒诊疗方案(2020年版)》印发
史上最致命疫情的肆虐史,或被10张切片改写



浙大34岁“歌神教授”:科研也是在创造艺术品




最新!2019年版流行性感冒诊疗方案来了,三张图读懂中医怎么治流感

10月份健康提示: 注意预防新冠肺炎、手足口病、流行性感冒

《流行性感冒诊疗方案(2020年版)》印发
猪流行性感冒
吃香蕉、西瓜会感染H7N9?

钟南山:新冠肺炎病死率远低于SARS、埃博拉和H7N9

如何正确使用退烧止痛药泰诺、布洛芬?| 117三人行