科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-22
来源:BioArt
撰文 | 伊凯
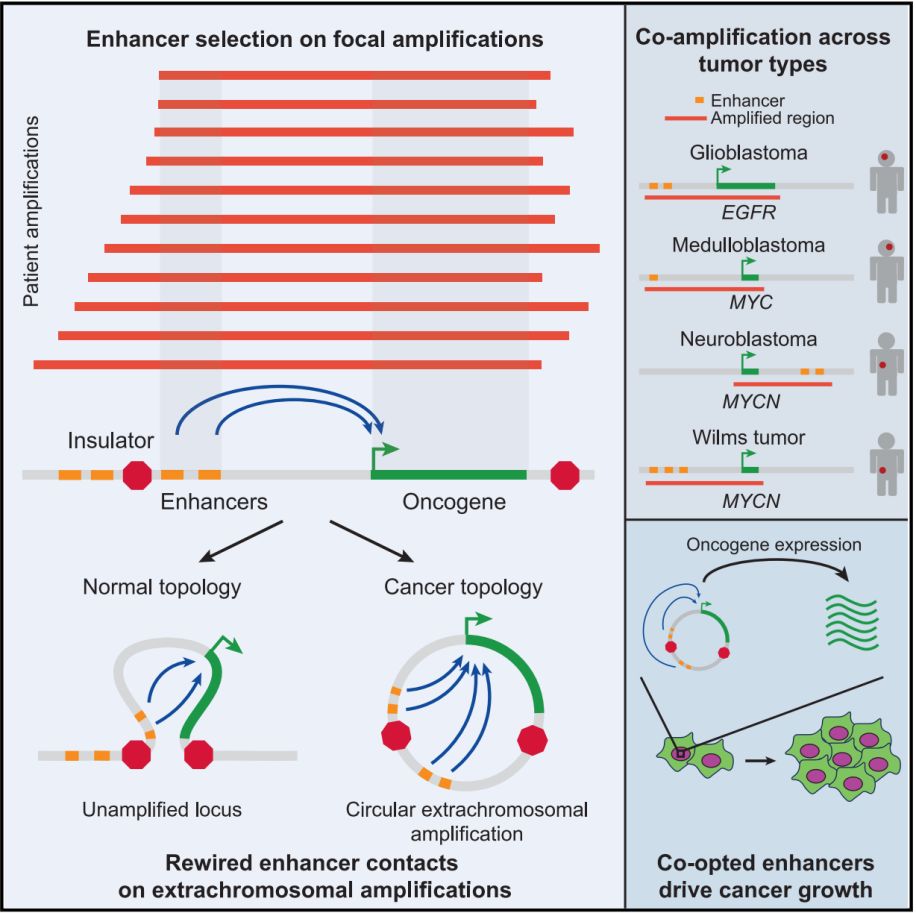
癌症的发生与发展依赖于纷繁复杂的分子机制的协同作用,其中癌基因(oncogene)在DNA层面的行为变异被认为是关键的驱动因素之一【1,2】,它包括了点突变(point mutation)和基因扩增(gene amplification)等激活机制。癌基因扩增基于作用区域的尺度可大致分为低级拷贝数增加(low-level copy gain)和高级扩增(high-level amplification)两类,其中后者是经由染色体碎裂(chromothripsis)等方式产生的大规模DNA重组【3】,而这类重组包括了一种以环状染色体外DNA(circular extrachromosomal DNA, ecDNA)形式存在的特殊扩增体。近年来的研究表明,ecDNA几乎不存在于正常细胞中,而存在于接近一半的人类癌症细胞中,且其往往富集于对癌基因的扩增【4】,表明了这类DNA对于肿瘤细胞进化可能存在的重要意义。
不过,以往对ecDNA的研究几乎完全集中在其对癌基因本身丰度的正向提升方面的作用,而较少关注到与癌基因一同扩增之非编码序列,尤其是以作用方式灵活、作用距离广著称的增强子【5,6】,潜在的价值。
2019年11月22日,来自美国凯斯西储大学(Case WesternReserve University)的Peter C. Scacheri与加州大学圣地亚哥分校的Jeremy N. Rich等合作在Cell上发表了题为Functional Enhancers Shape Extrachromosomal Oncogene Amplification的论文,报道了癌基因及其邻近增强子通过环状染色体外DNA的形式进行扩增从而增强已有联系或建立新的联系、促进癌症发展的全新分子机制。值得注意的是,就在本文在线前一天,Nature杂志报道了肿瘤中大量扩增的原癌基因是环状染色体外DNA(详见:Nature亮点 | 吴思涵等首次解析肿瘤染色体外DNA的环状结构与功能)

在该研究中,作者首先从肿瘤进化的正选择(positive selection)思想出发,系统地检测了癌症组织中具有随癌基因的扩增体产生对某一特定扩增方向的显著偏好的事件,发现了EGFR基因在成胶质细胞瘤(glioblastoma)中存在与其上游约130kb的非编码序列共同扩增的特征。将这段序列与用于标定启动子或增强子位点的ChIP-seq峰进行重叠分析发现,其中正好包含了两个很强的H3K27ac结合峰,暗示了增强子在此处的存在。而基于CRISPRi的转录干扰实验也验证了这两个潜在的增强子具有直接调控EGFR表达水平的能力。对由Roadmap Epigenomics项目提供的134个正常组织中增强子活性的分析发现,上述两个EGFR共扩增增强子的本底活性分别在海马结构(hippocampus)和胚胎干细胞体外培养衍生的神经球(neurosphere)组织中最高。作者认为,这一结果从组织特异性方面建立了其在成胶质细胞瘤中能够与EGFR发生显著共扩增的基础。
接着,为了具体描绘这一EGFR与邻近增强子共扩增事件的存在形式,作者利用9个独立的成胶质细胞瘤来源的体外细胞群进行了DNA原位荧光杂交(FISH)分析,证实了EGFR染色体外扩增体的存在,并利用对应的H3K27ac ChIP-seq数据中的双末端读本(paired-end reads)确认了这一扩增体的环形结构。在探明了这一共扩增的框架结构的基础之上,作者进一步分析了其内部各组分间存在的复杂相互作用。作为对照,作者首先利用已有的非EGFR扩增的成胶质细胞瘤细胞中的高通量染色体构象捕获(high-throughput chromosome conformation capture,Hi-C)数据展示了EGFR与两个相关增强子处于一个480kb的环形结构域中的事实。而利用检测单点对多点交互作用的环状染色体构象捕获(circularized chromosome conformation capturesequencing, 4C-seq)技术分别对具有和不具有EGFR扩增的成胶质细胞瘤细胞的分析则表明,EGFR与增强子的共扩增导致了EGFR的启动子与邻近的众多顺式调控元件的互作模式的剧烈改变。具体而言,在非EGFR扩增的肿瘤细胞中,除了基因体(gene body)内的增强子之外,EGFR启动子仅与前述的两个增强子具有显著联系;而在EGFR扩增的肿瘤细胞中,EGFR启动子尽管仍保持了与前二者的联系,但同时也获得了大量新的互作对象。
为了定量分析这些存在于EGFR非扩增和扩增细胞中的互作联系对肿瘤细胞的适应性的意义,作者设计了针对超过100个互作区域的共10000个sgRNA的CRISPRi筛选,在经过21天的筛选期后对sgRNA进行定量可准确地反映相应细胞群体的活性程度。结果发现,包括两个上游邻近增强子在内的多个于扩增后新获得的互作增强子都具有对EGFR扩增肿瘤细胞活性很强的正向效应。上述的一系列分析经由EGFR这个案例直观地展现了,肿瘤细胞中的癌基因通过高级扩增与环化而形成的对自身调控活性的增强,是一个十分有效的促癌机制。
最后,作者将同一分析范式迁移至多癌种的样本中,发现在5种不同实体肿瘤类型中均存在类似的癌基因与增强子的显著共扩增。例如,MYCN在神经母细胞瘤(neuroblastoma)和肾母细胞瘤(Wilms tumor)中分别于3’端和5’端的超级增强子发生共扩增,而这些增强子的活性都无一不在相应起源组织中具有最高的活性。
总之,这项研究综合利用各项计算分析和实验手段,首次揭示了增强子在癌基因环化扩增介导的促癌效应中所发挥的重要作用。这一机制从空间上极大地扩展了癌基因表达调控的动态可塑性,展现了超越通常规定的基因边界的整体调控网络作为一个功能单元,在癌症发生与发展中的关键角色。
原文链接:
https://doi.org/10.1016/j.cell.2019.10.039
参考文献
1. Hanahan, D. &Weinberg, R. A. Hallmarks of cancer: the next generation. Cell (2011).doi:10.1016/j.cell.2011.02.013
2. Vogelstein, B. et al.Cancer genome landscapes. Science (80-. ). 340, 1546–1558 (2013).
3. Korbel, J. O. &Campbell, P. J. Criteria for inference of chromothripsis in cancer genomes. Cell(2013). doi:10.1016/j.cell.2013.02.023
4. Turner, K. M. et al.Extrachromosomal oncogene amplification drives tumour evolution and geneticheterogeneity. Nature 543, 122–125 (2017).
5. Sur, I. & Taipale, J.The role of enhancers in cancer. Nat. Rev. Cancer 16, 483–493(2016).
6. Chen, H. et al. APan-Cancer Analysis of Enhancer Expression in Nearly 9000 Patient Samples. Cell173, 386-399.e12 (2018).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478070&idx=1&sn=9a8c485be42dfaf3201dcf5ab050501a&chksm=84e209c2b39580d4f34d2261ea7feeb29a1c0e9330ae312cb08a087b96d5d52b00e7686399d0&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
肿瘤防治中心徐瑞华教授团队牵头构建食道小细胞癌基因图谱
推荐阅读文章 | B19病毒非结构蛋白11 kD对p6启动子和细胞因子启动子的调控作用

人类染色体“X”档案破解,迷你“钥匙”决定DNA形状
增强子选择启动子的新模型
eLife:两种促癌基因或能互相协作促进癌症转移进展

全面分析拟南芥、玉米和高粱核心启动子,助力设计新启动子和作物改良
生工小课堂|启动子和终止子
癌症的武器是“进化”?科学家发现癌基因在染色体外DNA中扩增,可促进肿瘤发展

庄小威团队发表《Cell》揭示人类染色体3D结构成像
人类染色体