科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-26
来源:X一MOL资讯
副标题:脂肪胺N-H键的高对映选择性卡宾插入合成手性氨基酸
手性胺广泛存在于天然产物、药物分子和农用化学品中。2016年销售额Top 200的处方药中约43%含有脂肪胺结构,比如镇痛药氢可酮、抗抑郁药舍曲林、抗血小板聚集药氯吡格雷等(图1A)。过渡金属催化下高对映选择性地形成C–N键是颇受关注的手性胺结构合成策略,尤其是过渡金属催化N-H键的卡宾插入反应,具有反应条件温和、官能团兼容性良好、底物简单易得等、操作简单等优势。近年来,有多个课题组从芳香胺或酰胺出发,在手性过渡金属催化剂的存在下已经实现天然或非天然α-手性氨基酸衍生物的对映选择性合成(图1B)。然而遗憾的是,类似反应却无法以常见的脂肪胺类化合物为底物进行。这是因为脂肪胺是一种相对更强的Lewis碱,会与过渡金属催化剂进行强配位而致其失活,从而影响金属类卡宾的形成,导致N-H键插入反应难以进行。而且,过量的脂肪胺可能会与金属叶立德中间体反应,生成游离叶立德而生成外消旋产物(图1C)。
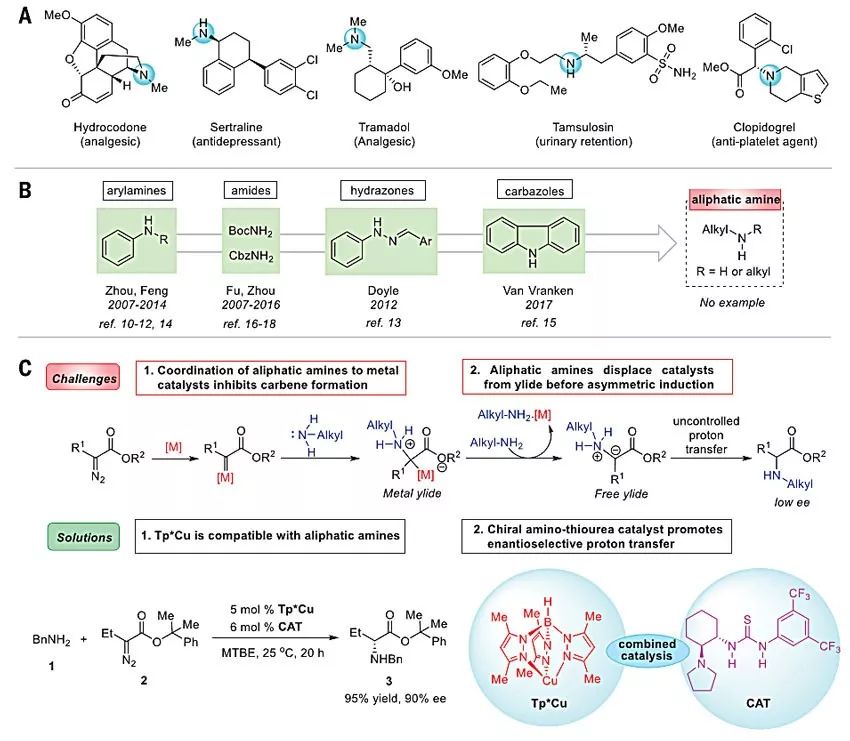
图1. 脂肪胺与卡宾的对映选择性N–H键插入反应策略。图片来源:Science
近日,南开大学周其林院士和朱守非教授团队报道了基于非手性铜配合物和手性氨基硫脲协同催化的脂肪胺N–H键的高对映选择性卡宾插入反应,该反应条件温和、官能团兼容性好、产率和对映选择性较高。该反应的关键在于非手性铜配合物催化剂(Tp*Cu,图1C)和手性有机催化剂氨基硫脲(CAT,图1C)的协同作用——非手性铜配合物催化剂活化底物生成叶立德中间体,然后手性氨基硫脲催化剂促进对映选择性质子转移。这就像是在拳击比赛中打出了一套决定胜利的漂亮“组合拳”,不仅解决了长期以来脂肪胺N-H键的高对映选择性卡宾插入反应的难题,同时也为α-手性氨基酸的合成提供了有效的方法。相关工作发表在Science 上,第一作者为李茂霖。[1]
在最佳反应条件下,作者首先考察了脂肪胺的底物范围(图2A)。苄基伯胺能够实现N-H键插入反应,以较好的收率(81-95%)和对映选择性(88-92% ee)得到相应的α-氨基丁酸衍生物(3-9),2-苯乙胺和正丁胺以中等的的对映体选择性得到目标产物10、11。仲胺也适用于该反应,但需要延长反应时间同时加入过量的重氮化合物。哌啶衍生物通常表现出优秀的对映选择性,当在其4-位引入吸电子基团时 (例如CO2Me 、CN),目标产物(13、14)的产率(71%、86%)和对映选择性(90%、94% ee)均得到了提高。吗啉、取代哌嗪和硫吗啉也能兼容该反应,以较好的产率和对映选择性实现N-H键的插入反应 。稠合杂环胺也得到了令人满意的产率和对映选择性的N-H键插入产物(20 、21)。然而,氮杂环和N-甲基-1-苯基甲胺的对映选择性却比较低(73% 、77% ee,22、23)。手性药物如阿莫沙平、曲美他嗪、伏替西汀的N-H键插入反应尽管反应进程较慢,但是仍能以较好的收率和对映选择性得到相应的氨基丁酸衍生物(24-26)(图2B)。在此基础上,作者进一步研究了吗啉在N-H插入反应中的重氮化反应物的底物范围(图2C)。无论是直链还是带有支链的α-烷基重氮乙酯,都具有优秀的对映选择性(94%-96% ee)以及较好的产率(66%-99%)(27-31)。烷基链上各种官能团(例如烯基、酯、醚、酰胺)都能兼容,并且产率较高(86%-99%),对映选择性较好(87%-96%)(32-38)。另外,α-芳基重氮乙酸酯也能够实现该转化,以较高的收率(>95%)和对映选择性(72%-89% ee)得到相应的芳基甘氨酸衍生物(39-44)。
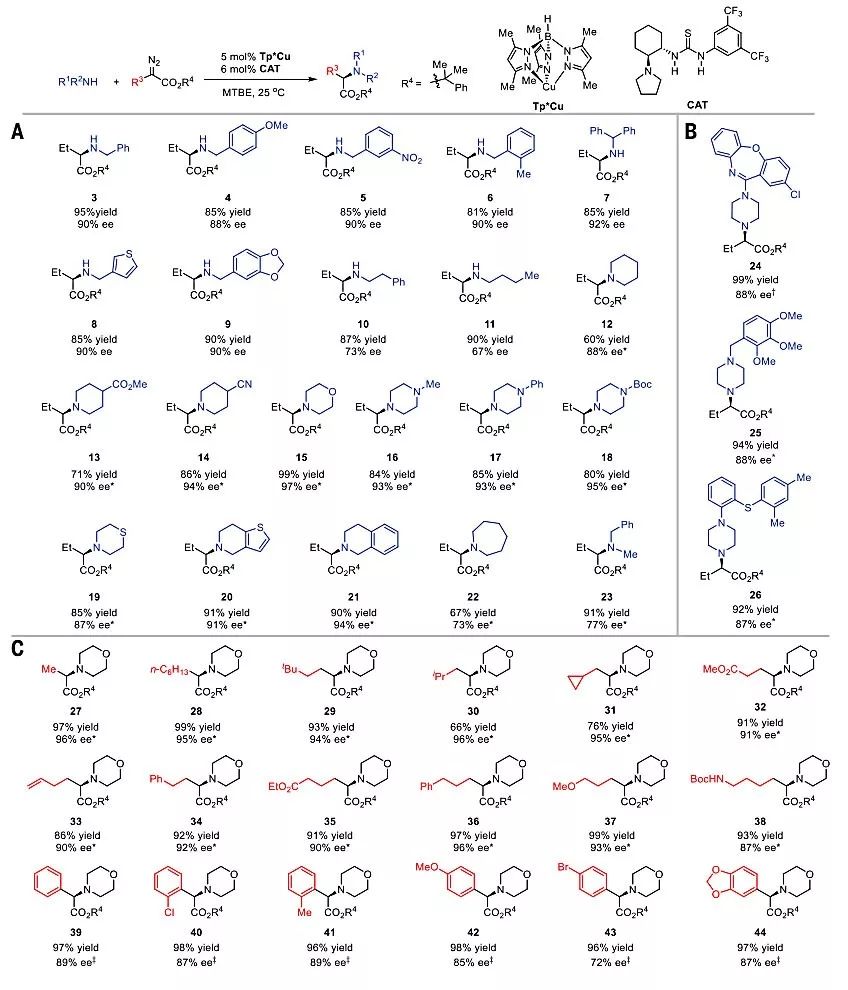
图2. 底物扩展。图片来源:Science
为了证明N-H键插入反应在合成中的应用价值,作者对插入产物进行了相应的转化。产物(R)-3在LiAlH4还原下,以较高的产率生成(R)-2-苄基氨基丁醇(R)-45且ee 值保持不变,这是合成γ-分泌酶抑制剂和PDK1抑制剂的中间体(图3A)。吗啉和重氮酯2的N-H键插入反应能够以克级规模制备产物15,其水解产物酸46,是合成治疗增生性障碍(HPD)药物的中间体(图3B)。通过产物27水解得到的(R)-2-吗啉丙酸47是合成PI3Kδ抑制剂以及DNA依赖蛋白激酶(DNA-PK)抑制剂的关键中间体(图3C)。
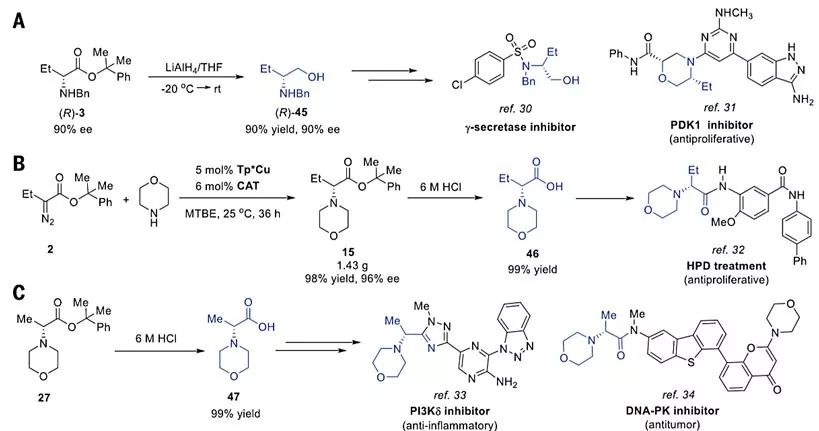
图3. N-H键插入产物的合成转化。图片来源:Science
为了进一步地探究N-H键插入反应的机理,作者使用原位红外(IR)光谱进行了动力学分析。结果显示该反应对Tp*Cu和重氮化合物2是一级动力学相关(图4A),这表明Tp*Cu催化重氮酯2的分解形成金属类卡宾化合物可能是反应的决速步。此外,该反应对CAT的负一级相关与硫脲催化剂CAT与TP*Cu之间的稳定态配合物的预平衡形成是一致的,这将抑制铜催化重氮酯的分解。然而,通常与金属催化剂配位并抑制金属类卡宾形成的苄胺在该反应中却表现出零级动力学效应,这表明CAT与Tp*Cu的配位能力要比苄胺强得多,苄胺的抑制作用则可以忽略。作者认为,带有负电荷的Tp*配体使铜催化剂具有较软的Lewis酸性,从而有利于与软碱(如硫)相互作用。密度泛函理论(DFT)计算表明,铜叶立德中间体中的铜催化剂可以与硫脲配位,释放出游离的叶立德或更稳定的互变异构体游离烯醇(图4B)。即使不加手性催化剂,这些中间体的质子转移过程仍然十分快速,并且可以通过痕量水、烯醇中间体、甚至底物自身介导。硫脲的Brønsted酸性和其碱性质子化的相似pKa值促进了质子的协同转移,其中硫脲使促进了新形成的立体中心质子化,而氨基则促进了烯醇去质子化。DFT计算显示Tp*Cu•CAT配合物是一种最小能级结构,其中Tp*Cu与硫脲硫原子的键合增强了其Brønsted酸性。随后,作者以Tp*Cu•CAT配合物为催化剂,通过DFT计算研究了确定对映选择性的质子转移步骤。
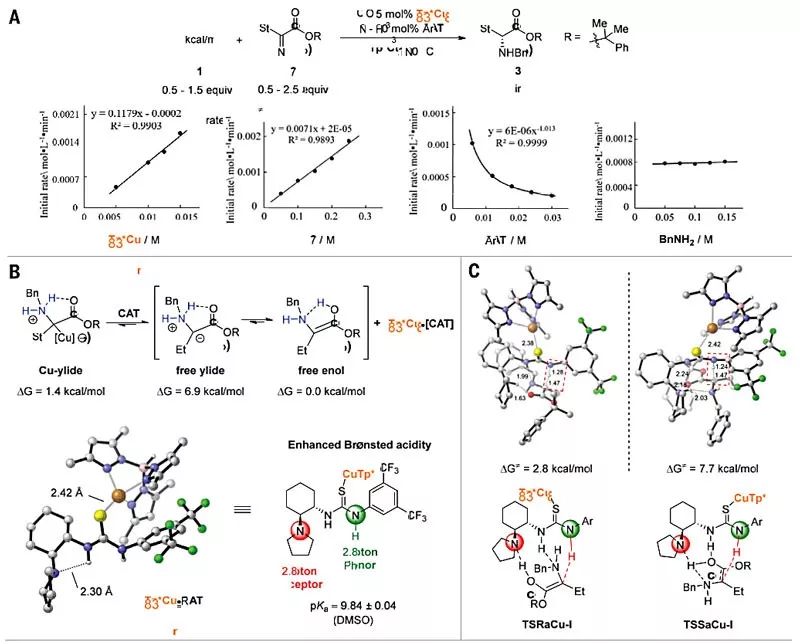
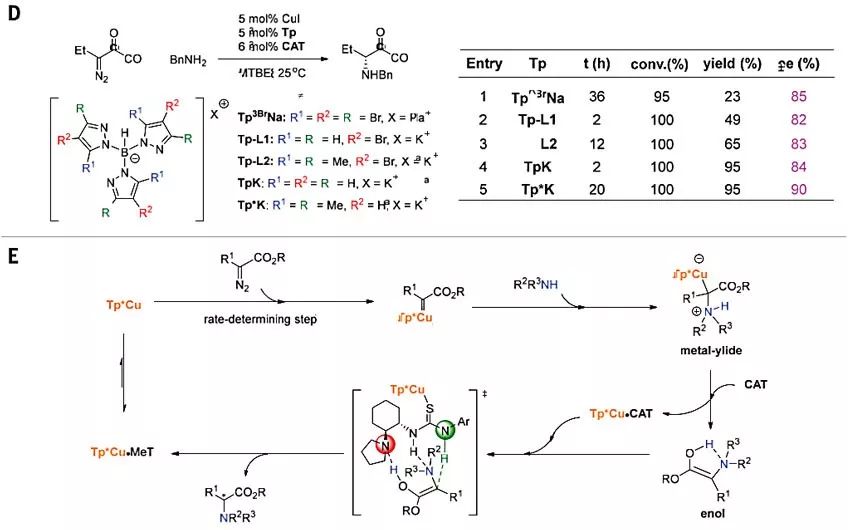
图4. 机理研究。图片来源:Science
在标准反应条件下,作者还评估了其他带有不同取代基的三(吡唑基)硼酸酯(Tp)配体(图4D)。所有Tp配体均具有良好的转化率(95%-100%),但收率变化很大(23%-95%)。当使用相同的手性硫脲催化剂时,经过修饰的Tp配体也会影响反应的对映选择性,这一结果表明铜催化剂参与了确定对映选择性的步骤。当改变手性硫脲催化剂上芳环的电性时,对映选择性急剧下降,而收率则几乎保持不变。作者认为,铜配位可增强硫脲催化剂的Brønsted酸性,同时对远距离的对映体诱导位点产生最小的影响(图4C)。基于上述机理研究,作者提出了可能的反应机理(图4E)。Tp*Cu•CAT配合物作为催化剂的稳定态解离释放Tp*Cu,催化重氮酯转化为金属类卡宾;接着脂肪胺亲核进攻得到了金属叶立德中间体;随后催化剂CAT取代金属叶立德中间体中的叶立德,生成游离烯醇和Tp*Cu•CAT络合物;然后,Tp*Cu•CAT复合物通过推拉机制(push-pull mechanism)促进游离烯醇中的质子转移:氨基部分接受来自烯醇羟基的质子,而硫脲部分将质子提供给烯醇的β-碳。
总结
南开大学周其林院士和朱守非教授课题组通过非手性铜配合物和手性氨基硫脲的协同催化实现了脂肪胺N–H键的高对映选择性卡宾插入反应,为手性氨基酸的合成提供了一种高效的方法。该反应条件温和、官能团兼容性好、产率和对映选择性较高。这种策略也为强配位底物的过渡金属催化的不对称转化带来了潜在的通用方法。[2]
哈佛大学Jacobsen教授在同期Science 杂志发表题为"A catalytic one-two punch(催化组合拳)"的评论文章 [3],对该工作进行了高度评价,他强调该反应的机制颠覆了手性有机催化剂常见的催化原理,使得手性氢键给体催化剂可以通过多种非共价机制促进立体选择性的控制。[2-3]
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657623860&idx=1&sn=4c4a75f68a186ae2f2c4d7cd9c25a80e&chksm=80f836e4b78fbff2f12f21d1bb86e7c32fcdc045748edc4d68720113f4eced7cd714df97c077&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
合肥研究院在狄拉克半金属Cd3As2纳米片中观测到平面霍尔效应----中国科学院
JACS:旧配体新手性!谭斌团队利用BINOL配体高效构筑轴手性联芳基化合物
Science:平面手性大环化合物的生物催化合成
河南大学发现手性含氮芳香杂环化合物合成新方法
研究发现手性含氮芳香杂环化合物合成新方法
巧妙设计新型手性轴向螺旋共轭碳桥化合物—spiro-CPV

Nature:惰性二氟亚甲基单元构建手性单氟化合物

浙大纳高团队——手性石墨烯纤维构筑的高灵敏度溶剂驱动系统

【每日科技速递】北京科技奖拟增“中关村奖”
理事推荐|Science封面:“你戳我,我就扭”的超材料诞生!


