科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-04-22
引言
单细胞技术的发展为揭开肿瘤的神秘面纱提供了新的手段。运用单细胞技术,能让我们从肿瘤的哪些角度入手,来解决哪些具体的问题呢?
对于肿瘤研究来说,可以从基因组不稳定、不受限制的复制潜力、细胞能量调节的失常、织织侵袭和转移、持续的血管生成、促进肿瘤的炎症和逃避免疫攻击等特征进行阐述。虽然大部分的肿瘤包含以上特征,但是,随着研究的深入,人们越来越认识到,对肿瘤内部的细胞亚群的认知至关重要。比如,肿瘤的不受限复制是由未分化的细胞亚群(肿瘤干细胞)所驱动;侵袭和转移可能是由上皮-间质转化(EMT)的激活或者其他侵袭相关的细胞引起;细胞的能量失调及持续的血管生成可能由肿瘤特定区域的,如经历缺氧和缺乏营养的细胞驱动;而肿瘤免疫逃逸可能也是由特定区域的细胞增强了免疫浸润引起。因此,对肿瘤亚群的了解有助于肿瘤亚型的识别,特别是在治疗或者治疗复发过程中的作用。
通过治疗消除癌细胞,但在随后出现了复发表明了肿瘤内部客观的异质性(intratumoral heterogeneity,ITH)存在。传统的基因组和转录组学方法对肿瘤的研究,只能揭示聚集的混合细胞的特征,而掩盖了ITH,单细胞“组学”的出现,为我们全面描述肿瘤的内部特征铺平了道路。那么,具体在哪些研究角度和层面,单细胞技术对于肿瘤研究能发挥它的一技之长呢?
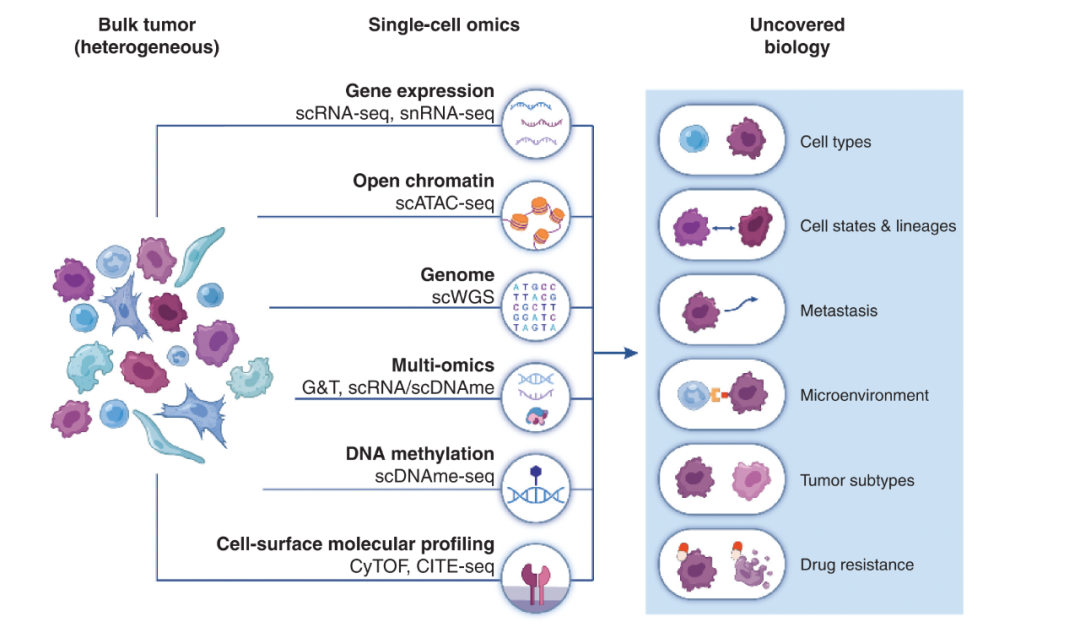
单细胞技术助力剖析肿瘤内的细胞特征
随着近年来的技术发展,现在已经能够实现从基因组,转录组,甲基化,染色质可及性,细胞表面/胞内蛋白角度进行单细胞研究。虽然从单个细胞的DNA测序去识别突变信息有一定难度,但是从拷贝数变异(CNA)角度进行分析还是能得到比较可靠和有用的数据。单细胞转录组测序(scRNA-seq)是现有运用的最广的进行肿瘤ITH研究的工具。通过该方法,既能从功能上,也能从遗传信息上进行分析。当然,最新的方法,除了常规的基因表达检测之外,已经能实现融合基因的检测,也能同时进行DNA和RNA的检测或者甲基化和转录组的检测。
尽管大部分的单细胞转录组测序需要新鲜样本进行实验,但是,通过对冰冻组织进行提核(snRNA-seq/sNuc-seq)来进行实验为临床肿瘤样本的利用提供了方案。这也将为在临床情景下,更广泛地对有时间跨度样本进行检测,以对肿瘤发展过程和对治疗的疗效进行评估提供了可能。
单细胞技术用于识别细胞类型和状态
利用单细胞转录组测序,能实现细胞亚群的分类,结合对每个类群中上调基因的解读可以对细胞的类型进行注释。然而,肿瘤样本的解读会面临挑战:把恶性细胞(可能由遗传变异)和非恶性细胞(基质细胞和免疫细胞)进行区分。因此,将基因表达信息和遗传变异信息的联合为解决该问题提供了一种可行方案。通常来说,现有的研究通过识别带有CNAs的细胞来识别恶性细胞,也以此来鉴定恶性细胞中的不同遗传背景亚型。
当然,由于单细胞技术对于基因突变检出和基因表达检测的局限,通过对更多基因信息或者结合多个基因的基因集角度来对细胞类型鉴定会更加准确。
对肿瘤内的细胞异质性的解读通常从两个方面入手:1)不同的细胞分属于哪些具体的细胞类型;2)每个细胞类型是否能反映出不同的细胞“状态”。分析细胞周期相关的基因集是常用的对细胞不同状态进行分类的方法。虽然不够精确,这种分析还是能对细胞周期激活或者非激活状态的细胞状态进行了区分。
从单细胞组学入手窥探肿瘤生物学
 a细胞谱系,分化和重塑
a细胞谱系,分化和重塑
肿瘤干细胞模型是肿瘤发展进程的基础,该模型认为肿瘤包含自我更新细胞亚群(某种情况下会引起对治疗的抵抗)和其他分化程度更高的细胞类型。利用单细胞转录组测序提供的数据,发现了肿瘤发展过程中不同状态的细胞类型,也发现了肿瘤中的细胞发展过程与正常细胞发育的相似性。
比如,在IDH突变的胶质瘤中鉴定到的细胞类型跟神经本身的发育状态相似。其中有一种神经祖细胞类型(NPC-like),为细胞周期激活细胞,是沿着星形胶质类似(AC-like)或者少突细胞类似(OC-like)世系发展的非增值分化细胞。这种现象同样在其他的如黑色素瘤,成神经细胞瘤,髓母细胞瘤和多种类型肺癌中发现。这些研究一方面证明了正常发育与肿瘤发展过程的相似性,同样也说明了肿瘤发展过程与正常分化过程中的差异。
比如,通过单细胞测序,发现了在治疗压力下,可能发生细胞向较早状态的细胞状态过渡。用BRAF抑制剂威罗非尼治疗后,源自患者的BRAFV600突变的黑素瘤细胞系在治疗三天后,显示向原始神经crest-like表型过渡,其中神经生长因子受体的表达升高,黑素细胞转录因子MITF的表达降低。这种向早期发育表型的转变被认为是耐药性适应的结果。
b肿瘤亚类分类
肿瘤研究的一个重点内容是鉴定不同的疾病亚型以进行针对性的治疗。利用普通的肿瘤基因表达数据很难实现这一目标。基于单细胞的分析为肿瘤分类提供了两方面的重要内容:1.通过单细胞数据得到的亚群来反映传统分类,这也表明现有分类的基础也是某类细胞占比;2. 通过描述特定细胞类型的作用及其相互作用,对广谱大分类的生物学结论提供新的认识。在黑素瘤中,常规认知将肿瘤分类为MITF高或AXL高,但单细胞分析显示两种细胞状态均在单个肿瘤中出现。值得注意的是,AXL高表达肿瘤中也会出现肿瘤相关纤维细胞(CAF)的高表达,说明AXL也会与其他相关的基因同时在肿瘤里表达丰度较高。同样地,这种现象在结肠癌,头颈鳞状细胞癌,卵巢癌中出现。因此,通过单细胞技术,既能发现肿瘤中的特殊恶性细胞,也能找到其他类型的非恶性细胞,这将为肿瘤的再次深入分型提供依据。
c肿瘤微环境和免疫治疗应答
肿瘤微环境(TME)的组成通过复杂的机制影响了肿瘤过程和治疗应答。肿瘤微环境细胞包括T细胞,巨噬细胞,内皮细胞和纤维细胞。这些细胞之间的互作沟通是实现生物学功能的基础。通过单细胞检测,可以尽可能地了解肿瘤内生态的详细组成。
CD8+效应T细胞可以裂解恶性细胞,但是,可能至少有两个不同的机制会导致其功能减弱:首先,慢性抗原刺激可能导致T细胞衰竭,丧失效应能力;其次,通过一系列复杂的机制,包括与其他TME成分(例如CAF,内皮细胞和巨噬细胞)的相互作用,可以将“浸润肿瘤的淋巴细胞(TIL)”从肿瘤核心“排除”。单细胞转录组测序提供了一种可能,通过剖析TME组成,探究耗竭特异基因的表达特征并确定免疫排斥的潜在机制。此外,通过单细胞免疫组库分析,还能发现不同的T cell亚克隆。通过对黑色素瘤的单细胞研究,发现了与T细胞活化,与患者肿瘤消退或进展相关的不同CD8+T细胞状态和特征基因,及T细胞被恶性细胞耗竭,预测对免疫检查点抑制剂治疗的反应。
d肿瘤微环境和免疫治疗应答
肿瘤发生转移是大多数死亡的重要原因。因此,通过单细胞技术,能为我们从不同的角度增加对转移的认识:
(1)对促进转移的细胞状态的特征了解;
(2)对配对的原位癌和转移癌组成的了解;
(3)对循环肿瘤细胞(CTC)的分析。
EMT是发生转移的重要特征,虽然带有一定的争议。但是,通过对HNSCC的单细胞研究发现,在肿瘤浸润边缘发现了EMT-like激活信号,同时是受到CAF调控并在转移患者中大量存在。其他的研究也得到了相近的结论。因此,针对EMT与转移的争论可能在不久的将来会有定论。
利用单细胞技术对CTCs细胞的研究,将有助于对转移早期阶段的理解。通过分析乳腺癌CTCs,发现了丰富的CTC亚群,并显示出显著的转移潜力。对CTC亚群的特征分析表明,粘连相关蛋白的基因表达上调,表明细胞转移能力增强了。
通过对配对的原位癌和转移癌样本的单细胞检测,可以鉴定他们之间的遗传差异,细胞类型组成和细胞阶段差别,有利于追踪转移过程中的细胞进化过程。结合克隆进化信息,有研究表明,多个克隆共迁移并建立了乳腺癌的浸润性病变过程。
e定向治疗的应答
治疗应答与微环境中的克隆选择和细胞适应相关,对恶性和非恶性细胞产生影响。传统的组织测序很难发现内在的组成,而单细胞测序则不同。对BRAF突变的黑素瘤单细胞测序,在治疗前的样本中鉴定到抗性相关的细胞特征。进一步的体外实验表明,治疗会使这个过程增强,这种情况可能不光是克隆选择,可能也与药物诱导的表观修饰改变有关。在ER + / HER2−乳腺癌中,单细胞测序表明,经过多疗程治疗后与原发性HER2 +乳腺癌相比,HER2表达增加,对靶向治疗的敏感性降低。
展望
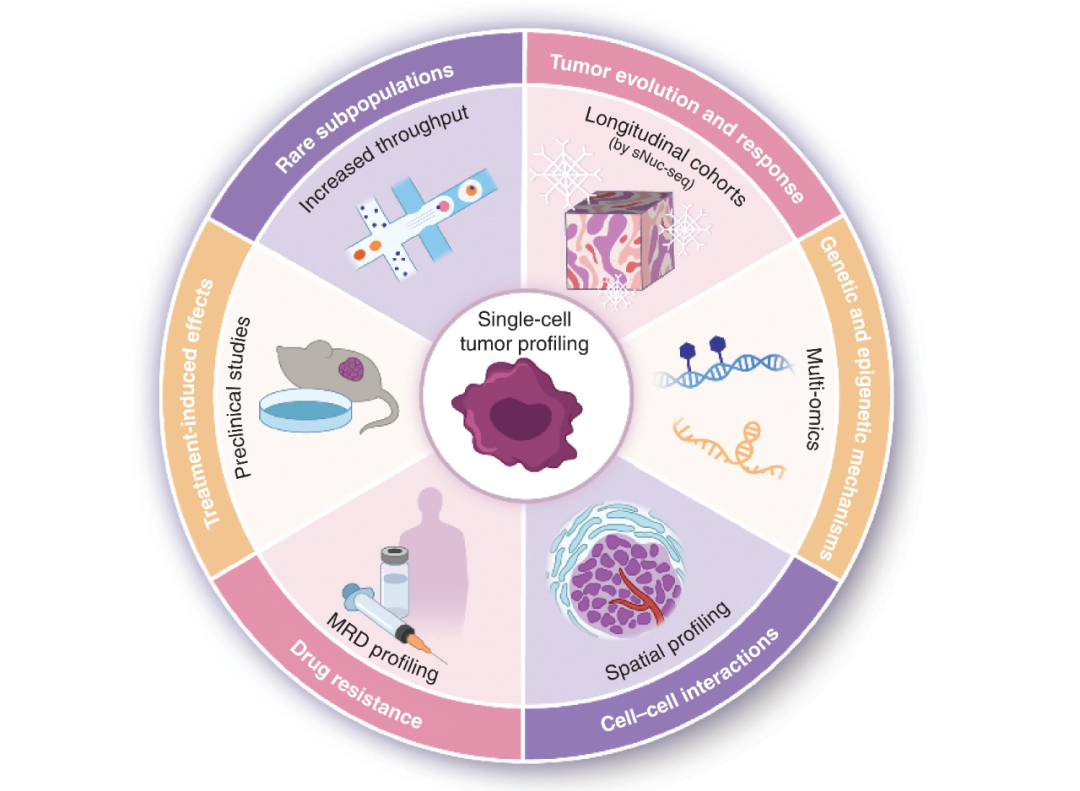
单细胞组学技术的出现和发展增进了我们对肿瘤异质性,肿瘤进化,肿瘤微环境和治疗反应的理解。同时,随着检测通量的提高,更多稀有的,具有临床意义的细胞亚群被发现。单细胞核RNA测序技术的出现为更多已经保存的既有临床样本提供了可行检测方案。单细胞甲基化,染色质可及性检测的出现丰富了探究细胞不同层面的深度。空间转录组的出现为更加深入了解肿瘤微环境中的细胞互作提供了可能。质谱技术的发展也为单细胞层面的蛋白和代谢产物检测提供了支持。从现有阶段来看,单细胞技术运用于肿瘤研究还处于早期阶段,随着研究的深入和技术的进一步发展,将为我们剖析肿瘤和治愈肿瘤提供更多新的见解。
参考文献:
L Nicolas Gonzalez Castro, Itay Tirosh, Mario L Suvà. Decoding Cancer Biology One Cell at a Time. Cancer Discov. 2021 Apr;11(4):960-970.
来源:上海生物芯片
原文链接:http://mp.weixin.qq.com/s?__biz=MzI1NTA5MTY1MA==&mid=2656038755&idx=1&sn=9a360eb9775d06eb4a11290573ec6c07
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Nature :单细胞测序技术解开肿瘤分型之迷

梦想青春不老?科学家用数学论证:衰老不可抵抗
中国抗癌协会肿瘤介入学专业委员会换届会议召开



单细胞测序揭示肺癌肿瘤免疫细胞亚型的细胞图谱
科学家新发现:癌细胞的另类杀手——合成非免疫细胞
让肿瘤细胞发光 新型水凝胶可追踪癌细胞位置

比单细胞DNA测序更胜一筹,准确描述单个癌细胞特征
这颗小行星杀死了恐龙,它留下的金属还能杀死癌细胞
通过单细胞测序技术揭示肝胆肿瘤异质性

Nat Comm:单细胞水平解析肿瘤微环境的细胞代谢图谱