科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-05-19
油菜素内酯(BR)是最近几十年来新确认的植物激素,被称为继生长素、细胞分裂素、赤霉素、脱落酸、乙烯之后的第六大激素。BR对植物的生长发育至关重要,其合成及感知相关突变体都呈现出一系列生长发育缺陷,如植株矮化、育性降低、生活周期延长及在黑暗条件下光形态建成等[1,2,3]。由于其对发育的重要性,在过去的二十年中,引起了很多研究关注,因此,其信号传导是拟南芥中研究最为透彻的信号转导途径之一。
2021年5月17日,比利时根特大学VIB 研究所Jenny Russinova 研究团队在Nature Plants 封面在线发表了题为Local brassinosteroid biosynthesis enablesoptimal root growth的论文,通过建立高分辨的BR合成时空图,揭示了BR合成的空间分布调节了激素以及信号的时空分布,从而为植物体内不存在长距离转运的激素如何精确驱动器官生长提供了范例。并且文章也提出了BR前体细胞与细胞之间转运的可能性。值得一提的是,该文被评选为同期Nature Plants封面文章。

BR信号始于BR配体与质膜(PM)定位的受体激酶BRASSINOSTEROID INSENSITIVE1(BRI1)的胞外域直接结合,引发一系列信号级联反应,最终通过改变下游关键转录因子BRASSINAZOLE RESISTANT1(BZR1)和BR INSENSITIVE EMS SUPPRESSOR1(BES1)/ BZR2的磷酸化状态,从而调控下游基因表达,精确调控植物生长发育 [4,5]。除了信号通路方面的研究,近年来,通过结合遗传学,质谱以及同位素标记等技术,BRs的合成网络已被成功建立,提出了一系列生物合成步骤,并以某种线性顺序排列了合成酶的位置[9]。在之前的报道中,BR已经被证实不存在长距离的运输[7],且在拟南芥中,BR信号通过沿纵向根轴建立信号梯度来控制细胞分裂和细胞伸长[8]。那么,这种信号的时空分布在没有长距离运输的情况下是如何建立起来的,目前还不清楚。
该研究首先通过建立BR合成酶(DWF4、CPD、ROT3、CYP90D1、CYP85A1及CYP85A2)转录以及翻译的报告转基因株系, 发现几乎所有的生物合成酶在根细胞伸长区(Elongation zone)达到最大表达水平,这一发现与BR信号的纵向分布是一致的[8]。而后,通过体外源施加BL(brassinolide)的实验,研究人员发现低浓度BL(10pM)可以完全挽救生物合成突变体的根分生组织结构,但无法回补伸长区细胞伸长;而高浓度的BL(100pM)可以回补伸长区细胞的结构,却导致分生组织的过早伸长,使得分生组织细胞数量和有丝分裂活性细胞产生率下降,这表明根部BR纵向浓度梯度分布对于发育的重要性。
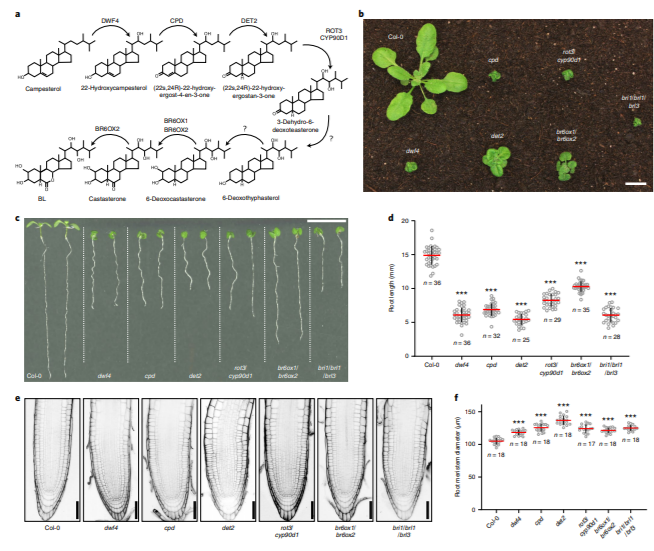
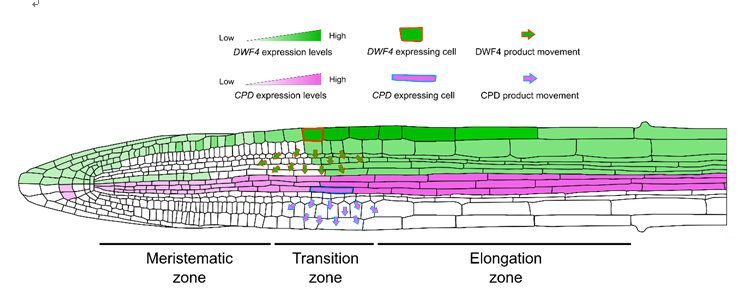
随后,研究人员试图通过测量BR在根部不同区域的含量来进一步印证这一结论,但由于拟南芥中BR含量极低,几乎不可能测定其含量。通过检索已有基因表达数据库,研究人员发现,BRs合成基因的表达模式在豌豆和拟南芥的根部一致[10]。因此,通过测量比较豌豆分生区和伸长区BR的含量,发现伸长区的含量远远高于分生区,与合成酶表达以及信号强度的空间分布相吻合,表明根部协调生长需要BR浓度的梯度分布,即分生组织中较低的激素浓度和伸长区中较高的激素浓度,这归因于生物合成的空间分布。有意思的是,研究人员还发现,并非每种根细胞类型都能表达所有BR生物合成酶,比如CPD特异性的表达在中柱细胞(Stele)中,而DWF4则主要表达在外皮层(Epidermis)。通过在合成酶突变体cpd中异位表达合成酶CPD,发现在内皮层表达的CPD仍然可以完全回补cpd突变体的表型,表明合成酶的表达位置不会影响BR的合成,暗示了BR前体可以在细胞不同层之间进行运输。为了进一步验证BR的细胞与细胞运输的可能性,通过在内皮层诱导特异性表达PHYB-4ACTIVATION-TAGGED SUPPRESSOR1 (BAS1)(催化BR的C-26羟基化并使BR失活),结果发现,经过诱导的植物呈现BR突变体的相关表型,并且BR信号强度变弱,进一步证明了BR在细胞层与细胞层之间短距离运输的可能性。
原文链接如下:https://doi.org/10.1038/s41477-021-00917-x
参考文献:
1. Gudesblat,G. E. et al. SPEECHLESS integratesbrassinosteroid and stomata signalling pathways. Nat Cell Biol14,548-554, doi:10.1038/ncb2471 (2012).
2. Kim,T. W., Michniewicz, M., Bergmann, D. C. & Wang, Z. Y. Brassinosteroidregulates stomatal development by GSK3-mediated inhibition of a MAPK pathway. Nature482, 419-422,doi:10.1038/nature10794 (2012).
3. Ye, Q. et al. Brassinosteroids control male fertility by regulating theexpression of key genes involved in Arabidopsis anther and pollen development. Proc Natl Acad Sci U S A107, 6100-6105,doi:10.1073/pnas.0912333107 (2010).
4. Yin, Y. et al. BES1 accumulates in the nucleus in response tobrassinosteroids to regulate gene expression and promote stem elongation. Cell109,181-191, doi:10.1016/s0092-8674(02)00721-3 (2002).
5. Vragovic, K. et al. Translatome analyses capture of opposing tissue-specificbrassinosteroid signals orchestrating root meristem differentiation. Proc Natl Acad Sci U S A112, 923-928,doi:10.1073/pnas.1417947112 (2015).
6. Zhao, B. & Li, J. Regulation ofbrassinosteroid biosynthesis and inactivation. J Integr Plant Biol54,746-759, doi:10.1111/j.1744-7909.2012.01168.x (2012).
7. Symons, G. M.& Reid, J. B. Brassinosteroids do not undergo long-distance transport inpea. Implications for the regulation of endogenous brassinosteroid levels. Plant Physiol135, 2196-2206, doi:10.1104/pp.104.043034 (2004).
8. Gonzalez-Garcia, M. P. et al.Brassinosteroids control meristem sizeby promoting cell cycle progression in Arabidopsis roots.Development138, 849-859,
9. Noguchi, T. et al. Biosynthetic pathways of brassinolide in Arabidopsis. Plant Physiol124, 201-209, doi:10.1104/pp.124.1.201 (2000).
10. Huang, L. & Schiefelbein, J.Conserved gene expression programs in developingroots fromdiverse plants. Plant Cell 27, 2119–2132 (2015).
来源:iPlants
原文链接:http://mp.weixin.qq.com/s?__biz=MzUzNzczODE4Mg==&mid=2247514453&idx=2&sn=e9ff83d30f70ff733da9b158554bfa63
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
根分生组织状态维持所需的生长素水平取决于油菜素内酯的双功能

The Crop Journal | 油菜素内酯调控玉米氮生理响应和氮素吸收
油菜素内酯信号转导研究获进展

储成才研究组合作发现一条隐藏在油菜素内酯信号组分中细胞分裂素信号通路调控水稻籽粒大小

人工细胞与生物细胞首次实现成功融合与协作

人体细胞内存在“铁路”系统,能自动优化结构
四川大学发现拟南芥油菜素内酯、生长素和细胞分裂素交叉调控根分生区发育的新机制
《细胞》发文!阿片类药物迎来重大突破

水稻油菜素内酯信号调控机制研究取得进展
失去细胞核的细胞在3D环境中举步维艰