科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-12-16
来源:X一MOL资讯
恶性肿瘤的发生、发展导致了肿瘤病灶区呈现特殊的肿瘤微环境(TME),如乏氧、低pH、H2O2过量、过氧化氢酶低表达等;这类特殊的微环境为癌细胞的生长、侵袭和转移提供了适宜条件,但同时也为肿瘤的高效选择性及特异性治疗提供了可能。基于此,步文博团队于2016年提出了一类新型的肿瘤治疗策略:化学动力学疗法(Chemodynamic Therapy,CDT),利用肿瘤区微环境中的弱酸性为反应条件,过量的H2O2为反应原料,基于过渡金属的功能纳米材料为催化剂,引发肿瘤细胞内芬顿或类芬顿反应,催化H2O2产生羟基自由基(•OH)等强氧化性的活性物种,诱导肿瘤细胞凋亡,实现基于肿瘤微环境特异性激活的高效治疗(Angew. Chem. Int. Ed., 2016, 55, 2101)。然而,如何借助于材料的巧妙设计,通过调控肿瘤微环境使其更高效激活CDT(Angew. Chem. Int. Ed., 2019, 58, 946),依然面临着巨大挑战。
近期,步文博团队从调控肿瘤微环境(pH和H2O2)的角度出发,借助于多类功能纳米材料,在增强型CDT纳米催化剂抗肿瘤研究上取得了系列重要进展。首先,肿瘤微环境的pH是影响CDT的关键因素,而肿瘤细胞内的微环境(pHi≈7.2),限制了通过胞吞进入肿瘤细胞内纳米药物的CDT效果。基于此,该团队从肿瘤微酸性的内源机理出发,提出了肿瘤细胞内“酸中毒”策略,显著增强了CDT的抗肿瘤效果。研究人员设计了一种TME响应性的CDT纳米药物:负载碳酸酐酶抑制剂(CAI)的非晶铁(AFeNPs@CAI)。AFeNPs@CAI可以响应肿瘤间质酸性微环境释放CAI,进而特异性抑制肿瘤细胞膜上过表达的碳酸酐酶蛋白(CA IX),高效阻止肿瘤细胞内H+外排,从而使H+滞留于肿瘤细胞内,达到肿瘤细胞内“酸中毒”的目的。该策略可以显著增加肿瘤细胞内的酸性,显著提升了肿瘤细胞内AFeNPs介导的芬顿反应效率,产物•OH可直接攻击胞内DNA、蛋白和线粒体等,实现了高效的肿瘤杀伤;同时,该策略也可以显著降低肿瘤细胞外(肿瘤组织间隙液)的酸性,减少细胞外基质的降解,在一定程度上抑制肿瘤细胞的转移和侵袭能力,从而提高CDT整体抗癌疗效。相关研究成果已在线发表于Advanced Functional Materials。[1]

其次,H2O2作为芬顿反应的底物,在肿瘤微环境中的含量同样也是影响CDT效率的关键因素。该团队从外源性提供过氧化氢的角度出发,巧妙利用金属过氧化物富含过氧根的特点,特异性响应肿瘤酸性微环境,产生大量过氧化氢,进而显著增强CDT效果。研究人员设计了一种TME响应性释放活性氧(ROS)的生物可降解的纳米前药:转铁蛋白修饰的MgO2纳米片(TMNSs)。TMNSs可以响应肿瘤酸性微环境快速释放大量H2O2,并与转铁蛋白中释放的铁离子发生芬顿反应,显著提升了•OH的生成量,用于肿瘤高效治疗;而在正常组织中,TMNSs降解速率较缓慢,且由于正常组织中过氧化氢酶功能正常,可以快速分解H2O2,生成氧气和水分子,赋予材料对正常组织良好的生物安全性。值得一提的是,材料作用后的终产物(Mg2+、H2O、O2),均具有很好的生物安全性,因而,该材料该体系具有潜在的临床转化应用价值。相关研究成果已在线发表于Advanced Materials。[2]
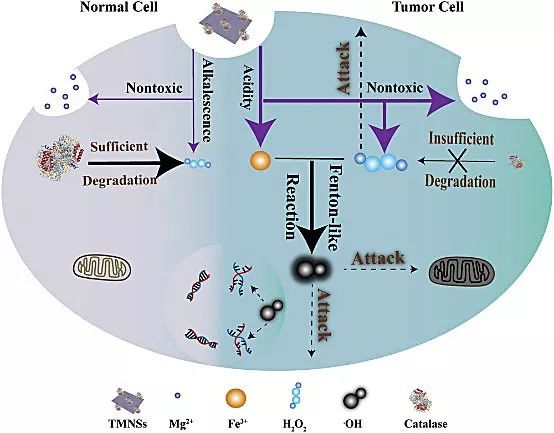
上述系列研究工作得到了国家自然科学基金(杰青)、科技部重点研发专项、上海市基础研究重大研究计划等经费支持。
1. 原文(扫描或长按二维码,识别后直达原文页面):

Amorphous Fe‐Based Nanoagents for Self‐Enhanced Chemodynamic Therapy by Re‐Establishing Tumor Acidosis
Xiaoyan Chen, Huilin Zhang, Meng Zhang, Peiran Zhao, Ruixue Song, Teng Gong, Yanyan Liu, Xinhong He, Kuaile Zhao, Wenbo Bu
Adv. Funct. Mater., 2019, DOI: 10.1002/adfm.201908365
2. 原文(扫描或长按二维码,识别后直达原文页面):

Biodegradable Nanoprodrugs: “Delivering” ROS to Cancer Cells for Molecular Dynamic Therapy
Zhong‐min Tang, Yan‐yan Liu, Da‐long Ni, Jia‐jia Zhou, Meng Zhang, Pei‐ran Zhao, Bin Lv, Han Wang, Da‐yong Jin, Wen‐bo Bu
Adv. Mater., 2019, DOI: 10.1002/adma.201904011
导师介绍
步文博
https://www.x-mol.com/university/faculty/37842
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657625164&idx=3&sn=f2cc0c3cd880fd19c230e12c313043a5&chksm=80f80d9cb78f848afd9fad7d6034ca268d0357368f3e7aad4bb190da791aeda7ddd0255b2742&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

【每日科技速递】国家发展改革委:大力推动营商环境改善

低毒性和高活性亦可兼得—新型纳米酶级联反应器用于饥饿疗法增强化学动力学治疗

全新给药方式可降低癌症复发率
肝脏肿瘤
Adv. Mater.:多酚金属联合纳米药物用于化疗与化学动力学疗法协同抗肿瘤
胃肿瘤

在US辐射下HPT-DOX的协同增强的化学-声动力学疗法能很好的抑制肿瘤生长
中国抗癌协会肿瘤护理专业委员会在津成立



肝脏肿瘤
肿瘤为何会复发?如何应对肿瘤复发?