科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-05-28

点击上面 蓝字 关注我们!
文章来源:中华糖尿病杂志, 2021,13(3) : 291-295
作者:马明磊 李玉秀
单位:中国医学科学院 北京协和医学院 北京协和医院内分泌科 卫生部内分泌重点实验室

摘要
2型糖尿病患者肿瘤发生风险及死亡风险均显著增加。二甲双胍作为公认的一线降糖药物,近年来有越来越多的研究发现,服用二甲双胍的糖尿病患者较未服用二甲双胍的患者相比,肿瘤发生风险及死亡率均有所下降。体内外研究也表明,二甲双胍可通过多种机制,发挥抑制肿瘤生长的作用,其中对能量代谢的调控可能起到重要作用。本文主要从能量代谢角度探讨二甲双胍在肿瘤中的作用及其可能的抗肿瘤作用机制。
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种以胰岛素抵抗和高胰岛素血症为特征的慢性进展性疾病,胰岛素抵抗和高胰岛素血症在T2DM发生前已经存在。许多证据表明,T2DM患者发生肿瘤的风险增加,例如胰腺癌发生风险增加1~2倍,子宫内膜癌发生风险增加近1倍,结直肠癌发生风险增加25%~40%,乳腺癌发生风险增加20%~30%[1]。T2DM患者肿瘤发生风险增加主要与胰岛素抵抗及代偿性的长期慢性高胰岛素血症、高水平的胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)有关;高水平的胰岛素和IGF-1可通过作用于胰岛素受体(insulin receptor,IR)及IGF-1受体(insulin-like growth factor receptor,IGF-1R),激活磷脂酰肌醇激酶(phosphatidylinositol kinase,PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、Ras/Raf/丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)通路,促进细胞生长和增殖。研究发现,许多肿瘤存在IFG-1R过表达的情况,如肝癌、结直肠癌、乳腺癌、前列腺癌[2]。因此,T2DM人群体内存在的慢性高胰岛素血症及高IGF-1状态,可促进高表达IR及IGF-1R的肿瘤细胞进行有丝分裂,加速肿瘤生长和转移。除此之外,T2DM与肿瘤的共同危险因素如肥胖、少动、不良饮食习惯等,以及T2DM伴随的慢性炎症、氧化应激及激素水平改变如瘦素水平增加、脂联素水平下降等[3, 4],均是促进肿瘤发生的重要因素。此外,与非糖尿病人群相比,T2DM患者肿瘤相关死亡率也显著增加,其中,胰腺癌死亡风险增加30%~40%,子宫内膜癌死亡风险增加14%~76%,乳腺癌死亡风险增加16%~61%,结直肠癌死亡风险增加21%~54%[1,4, 5]。
二甲双胍作为最常用的一线降糖药物,其降糖作用主要与抑制糖异生进而减少肝糖输出有关,此外,二甲双胍还可促进肌肉组织摄取葡萄糖,改善胰岛素敏感性,减轻胰岛素抵抗,缓解高胰岛素血症。除能够有效降糖以外,越来越多的研究表明二甲双胍还具有抗肿瘤的潜能;体内外研究表明,二甲双胍可能通过不同的作用机制,发挥抑制肿瘤生长的作用[6]。能量代谢的改变在二甲双胍的降糖和抗肿瘤作用中起着至关重要的作用,而肿瘤细胞的能量代谢特征与其他正常分化的组织细胞显著不同。因此,本文主要从能量代谢角度探讨二甲双胍抗肿瘤作用的可能机制。
一、二甲双胍与肿瘤的临床研究
研究表明,服用二甲双胍可降低肿瘤发生风险,改善肿瘤患者生存。一项前瞻性、多中心队列研究对T2DM患者随访5.8年发现,服用二甲双胍的患者较未服用二甲双胍者相比,肿瘤发生风险下降49%[7]。另两项前瞻性队列研究显示,服用二甲双胍可改善肿瘤患者总生存[8],肿瘤相关病死率亦有显著下降(HR 0.43,95%CI 0.23~0.80)[9]。但近年有两项随机、双盲、安慰剂对照的Ⅱ期临床试验发现,服用二甲双胍并不改善晚期胰腺癌患者的预后[10, 11]。一项meta分析共纳入28 671例受试者,发现观察性研究中,服用二甲双胍可降低肿瘤病死率35%,但随机对照试验(randomized controlled trial,RCT)研究中服用二甲双胍并未观察到肿瘤病死率的显著下降[12]。另有两项meta分析对胰腺癌患者按照临床分期进行分层,发现二甲双胍可显著改善早中期胰腺癌患者的预后,但对晚期、已发生转移的胰腺癌患者预后并无改善作用[13, 14]。由此可见,常规剂量的二甲双胍对晚期胰腺癌患者的获益并不明确,考虑可能由于RCT研究所纳入人群为已发生转移的晚期胰腺癌患者,而胰腺癌本身进展快、致死率高、化疗效果差、预后差,尤其晚期胰腺癌患者预后更差,因此常规降糖剂量的二甲双胍对晚期胰腺癌患者的总生存并无明显获益。
二、肿瘤的能量代谢特征
一般情况下,大多数分化良好的细胞增殖和生长所需的能量来源有两个途径。一个是糖酵解途径,葡萄糖在胞浆内多种酶的作用下经一系列反应生成丙酮酸,1 mol葡萄糖伴有2 mol三磷酸腺苷(adenosine triphosphate,ATP)净产生;另一个是三羧酸循环(tricarboxylic acid cycle,TCA)或者叫Krebs循环,可利用糖酵解途径生成的丙酮酸在线粒体经一系列氧化还原反应和电子传递生成二氧化碳(CO2)和水,最终1 mol葡萄糖分子对应产生36 mol ATP。在有氧情况下绝大多数分化良好的细胞将葡萄糖通过糖酵解途径生成的丙酮酸经TCA循环和氧化磷酸化,最大限度地产生ATP以供细胞生长所需;仅在氧气供应不足的情况下,如肌肉组织长时间锻炼时,丙酮酸会通过无氧糖酵解在乳酸脱氢酶(lactic dehydrogenase,LDH)的催化下生成乳酸。而肿瘤细胞的葡萄糖代谢与正常分化的细胞显著不同,许多肿瘤细胞对葡萄糖摄取能力显著增加,但对葡萄糖的利用并非主要通过TCA循环,而是以生成乳酸为主;即使在有氧情况下,绝大多数肿瘤细胞仍通过无氧糖酵解产生大量乳酸。这一现象最早由Otto Warburg于20世纪20年代提出,因此被称为“Warburg效应”[15]。这一现象发生的可能原因包括线粒体缺陷和功能障碍、为适应低氧的肿瘤微环境、原癌基因信号通路及代谢相关酶的异常表达[16]。
无氧糖酵解(2 mol APT/mol葡萄糖)与线粒体氧化磷酸化(36 mol ATP/mol葡萄糖)相比,是产生ATP非常低产的方法。但是葡萄糖经无氧糖酵解代谢的速率是十分迅速的,经无氧糖酵解生成乳酸的速率比经线粒体TCA循环和氧化磷酸化的速率快10~100倍,所以在一定时间内,两种葡萄糖代谢方式产生的ATP数量其实是相近的。因此,当能量供应有限时,低产但是高速率的ATP产生方式可能更有利于细胞对营养物质的竞争并满足其生长需求[17]。实际上,肿瘤微环境的葡萄糖供应是有限的,因此需要与基质细胞进行营养物质的竞争;而且细胞的环境改变使得对ATP需求量增加时,无氧糖酵解能够迅速增加,但氧化磷酸化并不能够快速增加[18]。这些都支持Warburg效应可以通过快速提供ATP生成,从而有利于满足肿瘤细胞快速生长的能量需求。
鉴于无氧糖酵解在肿瘤细胞的能量代谢中居于核心地位,肿瘤细胞的生长高度依赖于无氧糖酵解,因而针对糖酵解通路的治疗或许能够针对性地杀伤肿瘤细胞。当糖酵解通路被抑制时,肿瘤细胞由于通常还存在线粒体功能障碍,因而特别容易因能量供应不足而出现生长抑制。而对于线粒体功能完好的正常细胞来讲,当糖酵解通路被抑制时,细胞可能通过其他途径,如脂肪酸和氨基酸来产生TCA循环的中间产物,从而可以通过氧化磷酸化产生ATP,供细胞生长能量所需,因而使用糖酵解抑制剂对其他正常细胞生长的影响可能会相对较小[16]。一些针对糖酵解通路的药物已经显示出具有潜在的肿瘤治疗价值[16,19],并可通过抑制糖酵解途径改善肿瘤对传统化疗药物的抵抗,从而具有一定的临床应用前景。
三、二甲双胍与肿瘤能量代谢
体内外研究表明,二甲双胍可能通过多种机制发挥抗肿瘤作用。二甲双胍主要通过抑制线粒体电子传递链和ATP产生,促进腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)活化,抑制mTOR信号通路直接发挥抗肿瘤作用。二甲双胍也可通过改善高血糖症和胰岛素抵抗,缓解继发性高胰岛素血症,降低IGF-1水平,间接发挥抑制肿瘤细胞生长的作用。除此之外,二甲双胍还可通过抑制炎症反应、诱导细胞周期停滞、诱导细胞自噬、改变miRNAs的表达等多种机制影响肿瘤细胞的生长(图1)[20]。而能量代谢及其改变在二甲双胍抗肿瘤机制中发挥重要作用。
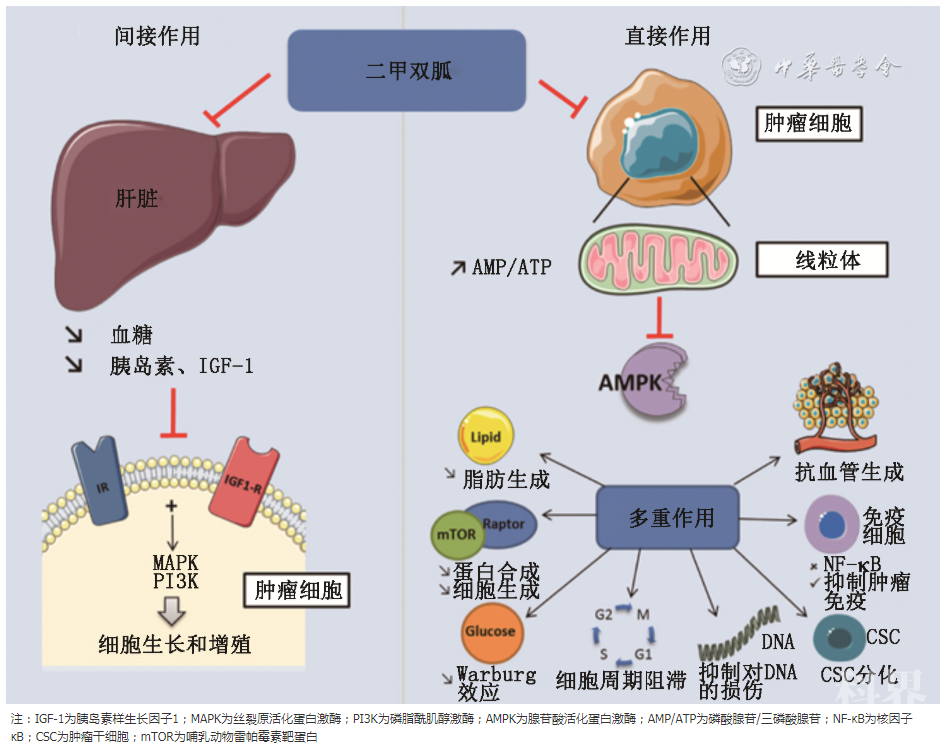
图1 二甲双胍可能的抗肿瘤作用机制图
1.二甲双胍通过抑制线粒体氧化磷酸化诱导能量应激:二甲双胍经口服吸收,由于二甲双胍具有极性,需通过膜转运体进入细胞,有机阳离子转运体(organic cation transporters,OCTs)是二甲双胍进入细胞的重要转运体,共有3个亚型[21]。OCT1几乎只表达于肝脏,因此肝脏成为二甲双胍发挥作用的重要器官;OCT2主要表达于肾小管,与二甲双胍的排泄有关;OCT3表达相对较为广泛,包括骨骼肌、心脏、脑、胰腺、肝脏等。二甲双胍经口服吸收入血后,会通过门静脉进入肝脏,而肝脏细胞高表达OCT1,因此成为二甲双胍发挥作用的主要器官。二甲双胍进入细胞后,主要在线粒体发挥作用,通过抑制线粒体电子传递链复合物I,使ATP产生减少[22]。通过减少细胞能量供应,使肿瘤细胞处于能量应激而容易死亡。同时,细胞内ATP产生减少,AMP/ATP比值增加,可激活AMP激活的蛋白激酶AMPK,通过AMPK下游信号通路进一步抑制细胞生长[23]。此外,由于线粒体呼吸链是产生活性氧的主要场所,二甲双胍通过抑制线粒体呼吸链,还能够减少内源性活性氧的产生,减少氧化应激及对DNA的损伤[24]。长期使用二甲双胍治疗的患者类似于热量限制的效果,可减少肿瘤发生率,延长寿命,可能与二甲双胍对线粒体复合物I的抑制、减少ATP和活性氧的产生、改善氧化应激以及通过激活AMPK调节能量平衡有关[25]。
2.二甲双胍通过激活AMPK调控能量代谢和细胞生长:二甲双胍除了可以通过抑制线粒体复合物I的活性,减少ATP产生,增加AMP/ATP比值来激活AMPK外,也可通过激活肝激酶B1(liver kinase B1,LKB1)激活AMPK[26]。AMPK是一种能量感受器,能够维持细胞内能量稳态。AMPK激活可抑制合成代谢来减少能量消耗,促进分解代谢来增加ATP的产生[27]。在正常细胞,AMPK使代谢平衡倾向于储存能量,这样可使细胞在代谢应激情况下更容易生存。但由于肿瘤细胞的能量需求更高,而AMPK激活可限制能量的利用,因此会抑制细胞的增殖和活性。同时,AMPK激活可使肿瘤抑制基因磷酸化激活,进而抑制多蛋白复合物mTORC1(mammalian target of rapamycin complex1,mTORC1),而mTORC1是调控细胞生长、整合多种激素信号和能量感知通路的关键分子。因而,二甲双胍可通过激活AMPK,抑制mTORC1信号通路,阻断蛋白质合成,进而抑制细胞增殖[28]。
在体外研究中,AMPK能通过激活mTORC2,使得处于能量应激状态下的细胞得以生存[29];这与AMPK通过抑制mTORC1进而抑制细胞生长是相互矛盾的。体内研究也表明,AMPK功能正常有利于肿瘤细胞在能量应激时能够进行适应性的代谢调整,从而保护细胞免于死亡[30]。LKB1是使AMPK磷酸化激活的主要上游激酶;研究显示,二甲双胍用于治疗LKB1缺陷的肿瘤细胞时,由于无法通过激活LKB1-AMPK通路对二甲双胍造成的能量应激进行适应和调节,会增加细胞对二甲双胍的敏感性,细胞更容易发生死亡[31]。由此可见,二甲双胍通过抑制线粒体呼吸链,抑制ATP产生,对细胞造成能量应激的同时,一方面激活AMPK可抑制细胞生长,另一方面AMPK也促使细胞对能量应激作出适应性代偿,因而可能会削弱二甲双胍对细胞生长的抑制作用。
3.二甲双胍与糖酵解:二甲双胍对肿瘤细胞糖酵解的影响还存在争议。一些学者认为,由于二甲双胍能抑制线粒体呼吸,减少ATP产生,诱导能量应激,可反过来刺激糖酵解,以此作为能量应激时机体的能量来源[32]。虽然确实在某些细胞中观察到AMPK激活可刺激糖酵解[33],但也有研究显示,AMPK可负性调节无氧糖酵解,抑制肿瘤生长[34]。而且从长期来看,AMPK激活会通过上调线粒体生物合成促进氧化磷酸化,并通过抑制mTORC1下调缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)的表达[35],而HIF-1α可促进糖酵解相关酶的基因表达。因此AMPK可通过抑制mTOCR1下调HIF-1α进而抑制糖酵解。而LKB1或AMPK缺失小鼠的HIF-1α和下游糖酵解相关基因表达上调,也支持AMPK可抑制糖酵解这一观点。体外研究表明,二甲双胍可通过抑制HIF-1α基因表达,进一步抑制葡萄糖转运体(GLUT1、GLUT3)及糖酵解通路相关酶的表达,从而抑制Warburg效应[36]。因此推测二甲双胍通过激活AMPK,抑制mTORC1通路,下调HIF-1α表达进而抑制糖酵解,可能是二甲双胍抑制肿瘤生长的另一机制。
也有一些研究发现,二甲双胍可通过下调糖酵解通路的重要调节酶如LDH活性,抑制糖酵解水平[37]。据报道,LDH在某些类型的肿瘤中表达发生变化,并有可能成为肿瘤的潜在治疗靶标[38]。而根据上文所述,绝大多数肿瘤细胞即使在有氧情况下也高度依赖无氧糖酵解快速产能,因此通过抑制糖酵解,逆转Warburg效应,或许是二甲双胍抑制肿瘤细胞生长的重要机制。而鉴于二甲双胍目前未能应用于临床抗肿瘤的一个重要问题在于,体内外研究中所用的二甲双胍浓度远远高于临床研究中常规剂量二甲双胍所能达到的药物浓度。因此联合二甲双胍和糖酵解抑制剂,或许可显著增强肿瘤细胞对二甲双胍的敏感性,从而可以减少二甲双胍的干预浓度,增加其临床应用和获益的可能。
四、争议与展望
体内外研究中,确切证实二甲双胍具有抑制肿瘤细胞生长、促进细胞凋亡的作用;但在人群研究中,结果却不尽一致。一个很重要的原因在于临床前研究与临床研究中所用的二甲双胍浓度差别很大。二甲双胍推荐用于治疗T2DM的最大剂量为2 500 mg/d(35 mg·kg-1·d-1),常规剂量二甲双胍经吸收后在肝脏中的浓度大约50~100 μmol/L,高于门静脉(40~70 μmol/L)及外周血(10~40 μmol/L)[39]。而大多数体外研究中所用二甲双胍浓度常波动于2~50 mmol/L,动物研究中所用二甲双胍剂量甚至高达750 mg·kg-1·d-1[40],远高于临床常用的二甲双胍剂量,因而可在一定程度上解释为什么体内外研究证实二甲双胍具有明确的抗肿瘤作用,而人群研究的结果却不尽一致。
除了二甲双胍的干预剂量可影响其有效浓度,进而影响其抗肿瘤效能外,肿瘤细胞对二甲双胍的摄取也在很大程度上会影响二甲双胍在细胞内的有效浓度,进而影响二甲双胍的抗肿瘤效果。上文已提到,二甲双胍需通过转运体OCT1进入细胞,而OCT1几乎只表达于肝脏,除肝脏外,非肿瘤组织一般不表达OCT1;肿瘤细胞可表达OCT1,但不同肿瘤细胞的OCT1表达水平不同,肿瘤细胞OCT1表达水平下降会减少对二甲双胍的摄取,进而影响细胞内二甲双胍的有效浓度及其作用的发挥。评估肿瘤细胞OCT1表达水平,选择性地将二甲双胍应用于OCT1表达水平较高的肿瘤,有利于更好地发挥二甲双胍的抗肿瘤作用。
总之,关于二甲双胍治疗肿瘤的临床研究结果虽不尽一致,但体内外研究确实证实二甲双胍可通过多种机制发挥抑制肿瘤细胞生长的作用。参与二甲双胍抗肿瘤作用机制的关键分子或通路发生变化,均可能会影响二甲双胍抗肿瘤作用的效果。由于AMPK和mTORC1在能量代谢和细胞生长方面发挥重要作用,并且是二甲双胍的重要作用靶点,因此将来或许可考虑在二甲双胍的基础上,联合使用靶向于AMPK、mTORC1或其他调控代谢的关键信号分子,以达到协同增强抗肿瘤的效果。此外,由于糖酵解在肿瘤细胞能量代谢中的关键作用,而二甲双胍也显示出对糖酵解具有一定的抑制作用,还需进一步研究探索具体机制,并可考虑二甲双胍联合糖酵解抑制剂,以优化临床应用并达到更好的抑制肿瘤生长的作用。
参考文献 略
来源:中华糖尿病杂志

来源:CDS-TNB 中华医学会糖尿病学分会
原文链接:http://mp.weixin.qq.com/s?__biz=MzI1ODE4ODkxMg==&mid=2247498467&idx=3&sn=d795ededd74066c1d55c10836f9d959e
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn