科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-12-21
来源:X一MOL资讯
蛋白质是生物系统中最重要的功能性分子之一,生物的各类生命活动都离不开蛋白质的参与。然而蛋白质精密的结构和复杂性却使对于蛋白质的研究困难重重。从研究各种蛋白质的功能这类基础问题,到疾病的精准治疗这类应用问题,都离不开一种能够精准地操控蛋白的手段。近日,德克萨斯大学达拉斯分校的秦真鹏教授团队通过金纳米颗粒的热效应,实现了在活细胞上对于两种细胞膜蛋白的精准灭活。重要的是,这种手段并不依赖于基因编辑,因此也更具有应用价值。
对于蛋白活性的精准控制一直是生物工程领域的热门话题,尤其是在生物系统内控制蛋白质的技术更是用途甚广。在过去的十年中,已经有一些技术在这一领域初有建树,包括著名的光遗传技术(optogenetics),发光基团辅助光失活(chromophore-assisted light inactivation,CALI),以及合成分子光开关(synthetic photoswitches)。这些手段极大地促进了人们对于蛋白质功能的理解,并在生物医疗领域产生了重大影响。然而,目前大多数的技术严重地依赖于基因编辑。这使得它们在医学转化方面的前途受到影响。因此,一种不依赖于基因编辑的蛋白控制技术将为此领域带来重要进展。
为了达到了进准控制蛋白活性的目的,秦教授的团队另辟蹊径,借助金纳米颗粒的光热效应在纳米尺度对蛋白分子进行热灭活。金纳米颗粒会吸收特定波长的光并产生热,这种光热效应被应用于众多生物医药研究,对于癌症的热疗就是其中之一。简单地说,热疗是通过升高部分组织的温度来引起特定组织凋亡而不伤及其他区域的手段。从传热学的角度,热的传导范围与时间息息相关。因为肿瘤的尺寸较大,传统热疗至少需要几分钟的时间,以创造范围足够大的温度场杀死肿瘤。借用热疗的概念,如果能将加热的时间缩短至纳秒,同时提高能量密度,我们就可以创造出极小,甚至纳米尺度的高温场用以灭活特定蛋白而不伤害细胞。因为加热尺度与分子尺度接近,这种技术被称为“分子热疗”。分子热疗需要将金纳米颗粒与目标蛋白相连接,在纳秒脉冲激光的照射下,金纳米颗粒会产生足够高的局域高温场使目标蛋白灭活而不会造成细胞凋亡。
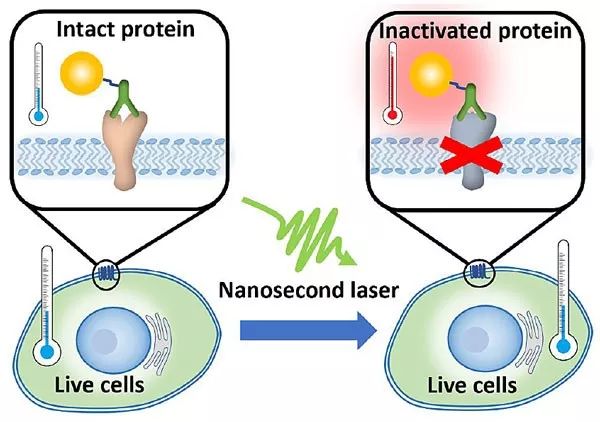
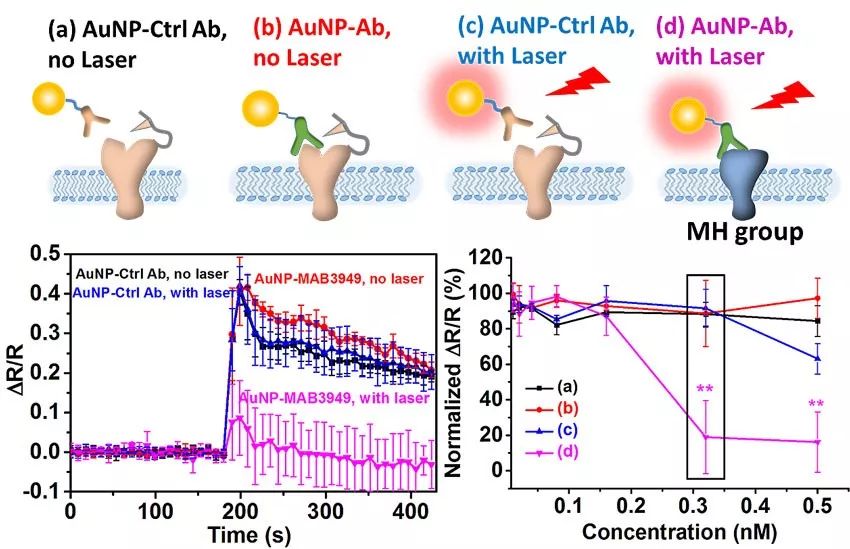
首先,分子热疗的有效性在溶液环境下进行了测试。测试发现通过胰凝乳蛋白酶连接于金纳米颗粒表面,纳秒激光脉冲能够十分有效的灭活连接在金纳米粒表面的蛋白酶而不会造成溶液整体的温度提升 [1]。有趣的是,通过对分子热疗中纳秒时域的蛋白灭活行为进行分析,研究发现高温下蛋白分子的去折叠反应动力学与低温时传统的Arrhenius model有着明显的区别 [2]。接着,分子热疗被用于活细胞膜蛋白的灭活。通过表面修饰抗体,金纳米颗粒可以特异性地连接于细胞表面的蛋白酶激活受体2(Protease activated receptor 2, PAR2)。在进行激光脉冲照射之后,连接有金纳米颗粒的细胞的PAR2活性相较于对照组下降明显。PAR2的失活会维持4个小时左右,而后缓慢恢复。重要的是,细胞活性并不会因为分子热疗产生明显下降,这证明了分子热疗对于细胞的安全性。最后,另一种膜蛋白-连接黏附分子A (Junctional adhesion molecule A,JAM-A)也被证明可以被分子热疗灭活。并且JAM-A的灭活会引发体外血脑屏障模型的打开。因此分子热疗将有可能发展成一种开启血脑屏障的有效手段。
这一成果近期发表在ACS Nano上,文章的第一作者是德克萨斯大学达拉斯分校的博士研究生康培元。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657625572&idx=8&sn=68234d4e8f16aaf98e5cbf84fb65b3b3&chksm=80f80c34b78f85224564fee095bbfe10e927c882afd433b4f858ae6357163d66d2fec65ad4ca&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

CellReports:武宁教授等揭示细胞膜脂搅乱酶TMEM16F参与细胞膜修复
红细胞膜磷脂

天价冬虫夏草能否抗癌成“罗生门”
失去细胞核的细胞在3D环境中举步维艰
细胞膜流动镶嵌模型的提出及发展
胰岛细胞膜抗体
让DNA与细胞膜“聊天”

新概念细胞器,支持各种细胞膜表面的蛋白质翻译
抗心肌细胞膜抗体
整合素机械-化学信号诱导产生细胞膜纳米结构域或可促进细胞运动