科技工作者之家
加好友
科技工作者之家 2021-06-11
一、偶联物的设计合成及药物释放机制研究
如图1所示,研究分别利用磷酸二酯键(Con-1)、双硫键(Con-2)、氨基甲酸酯键(Con-3)设计了三种Sgc8c–CA4偶联物,并采用自动化模块合成技术和生物偶联策略来合成这些偶联物。
图1 核酸适配体-CA4偶联物的构建
在药物释放机制研究方面,研究人员首先利用1型磷酸二酯酶(PDE1)来降解核酸适配体,发现Con-1可以在0.5 U/mL PDE1的环境中迅速(2小时内)原位生成CA4,这表明Con-1相比于其他两种偶联物具有更高的抗癌效果。更有趣的是,研究还发现Con-1还能响应谷胱甘肽进行缓慢降解并释放药物。进一步地实验表明,含磷酸二酯键的偶联物在谷胱甘肽溶液中的降解与含双硫键(典型的谷胱甘肽响应片段)的偶联物相似,证实了Con-1既能响应1型磷酸二酯酶降解,也能响应谷胱甘肽降解,从而释放CA4(图2)。

图2 偶联物的药物释放机制
二、偶联物的细胞实验
研究人员在肿瘤细胞系中对偶联物进行了细胞毒性的评价。实验发现(图3),由于存在核酸适配体,这些偶联物能够高度特异性地结合细胞。而在细胞毒性方面,由于Con-1对磷酸二酯酶和谷胱甘肽均表现出响应性,因此可释放更多CA4,从而更快速有效地杀伤肿瘤细胞。而基于Con-1和Con-2,研究还进一步利用靶向CD71的核酸适配体设计了两种偶联物,即具有磷酸二酯键的XQ-2d-(PO4)-CA4和具有双硫键的XQ-2d-(S-S)-CA4。细胞毒性检测表明,当在低浓度(0.4−3.70 nM)时,XQ-2d-(PO4)-CA4相比于XQ-2d-(S-S)-CA4更具毒性(抗癌效力);而当在高浓度(11.1 nM /100 nM)时,XQ-2d-(PO4)-CA4与XQ-2d-(S-S)-CA4的毒性相似,这应该可归咎于肿瘤细胞对CA4具有高敏感性的缘故。总而言之,这一工作说明通过研究偶联物的键链化学可以为调控、改善抗癌药物的效力提供新的思路和策略。
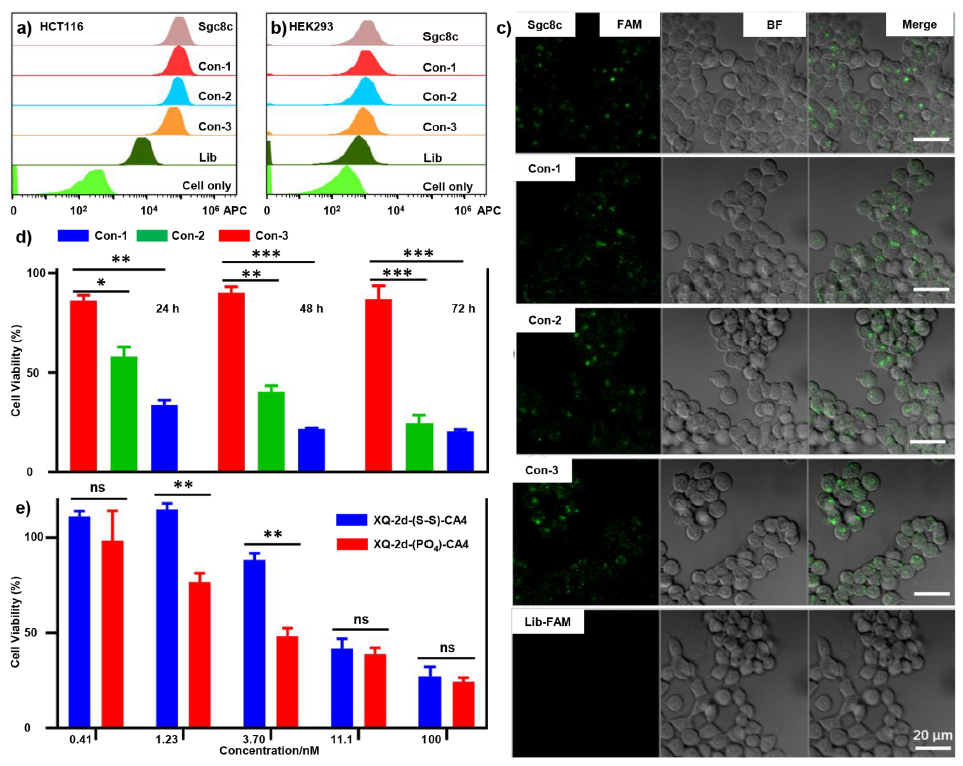
图3 细胞亲和、内化以及毒性测定实验
来源:高分子科学前沿
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5NjM5NzA5OA==&mid=2651791876&idx=6&sn=b19e1f8eb47d7311e310c5eba09fb70e
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
大脑中发现“焦虑细胞”,为治疗焦虑症提供新方向

Sci Adv:MHC-非限制性细胞毒性淋巴细胞杀伤肿瘤细胞的新调控因子
邵峰组Science报道细胞毒性淋巴细胞诱导细胞焦亡的机制
红细胞还原型谷胱甘肽(GSH)及稳定试验
慢性毒性作用
研究发现呕吐毒素致人源性细胞毒性相关的关键因子

超大规模测序揭示长寿的奥秘:细胞毒性T淋巴细胞是其中的关键

“促癌黑手”Ter细胞首次发现
生殖毒性

Science:打破30年的认知,邵峰团队发现细胞焦亡可出现在细胞毒性淋巴细胞