科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-06-28
6月25日,中国科学院生物物理研究所研究员叶克穷课题组和北京生命科学研究所研究员杜立林课题组合作在The EMBO Journal上,发表了题为Molecular and structural mechanisms of ZZ domain-mediated cargo selection by Nbr1的研究成果。该研究发现了裂殖酵母自噬受体Nbr1的两个新货物,并揭示了Nbr1如何通过单个ZZ结构域识别两个不同蛋白质的结构机制。
自噬是将细胞质物质运送至溶酶体的过程,该过程对维持细胞稳态具有重要意义。根据不同的底物特异性,自噬可分为非选择性和选择性的,在选择性自噬中,货物被自噬受体特异性识别。杜立林实验室于2015年在裂殖酵母中发现一种新型的选择性自噬通路,这个被称为NVT(Nbr1-mediated vacuolar targeting)通路利用自噬受体Nbr1把胞质水解酶Ape2和Lap2转运到液泡中。和经典的巨自噬通路不同,NVT通路依赖于内体的运输机器,并不形成自噬小体。目前,学界已发现了多种自噬受体,但尚不清楚它们如何特异识别货物。
该研究中,研究人员首先发现Nbr1能够结合两个新的货物蛋白质——甘露糖苷酶Ams1和氨基肽酶Ape4,确定了这两个蛋白质竞争性的结合在Nbr1的第一个ZZ结构域。研究人员利用冷冻电镜技术分别解析了Ams1和Ape4结合Nbr1-ZZ1复合物的结构,发现Nbr1的ZZ1结构域不仅通过保守的酸性口袋识别货物肽链的N端,也通过货物特异性的界面识别货物。此外,研究人员还利用突变实验证实了两个结合界面的重要性。该研究揭示了在自噬受体Nbr1结合货物的过程中利用单个ZZ结构域识别两个底物的双重特异性的机制,扩大了对ZZ结构域识别蛋白质模式的认识。
研究工作获得国家自然科学基金委、中科院战略性先导科技专项、科学技术部重点研发计划和北京市政府等的资助。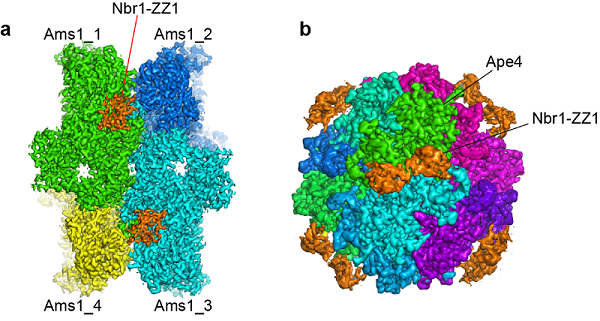
Ams1-Nbr1和Ape4-Nbr1复合物的冷冻电镜结构
来源:中国科学院
原文链接:http://www.cas.cn/syky/202106/t20210625_4795005.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
结构域

研究揭示自噬受体Nbr1的FW结构域识别蛋白质的结构机制

由结构域边界插入来调节基因组的空间折叠

首次在动物水平上揭示PROTAC工具对FAK蛋白非激酶结构域的调控

聚酮合酶脱水双模块结构域催化Z型双键形成的机制
研究揭示了TNLs的直接结合、寡聚和TIR结构域激活机制
深度突变扫描揭示新冠病毒S蛋白受体结合结构域突变对S蛋白折叠和结合ACE2的影响

蛛丝延展性的奥秘
Nature Genetics:解析基因座拓扑相关结构域(TAD)的功能

研究揭示双加氧酶的低复杂度结构域调控DNA氧化去甲基化