科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-12-28
来源:药学进展
专家介绍:刘李

教授,博士生导师,江苏省“青蓝工程”学术带头人、“333工程”第三层次和“六大人才高峰”培养对象,中国药理学会药物代谢青年委员会副主任委员兼秘书长,现任中国药科大学药学院药理系教师,为本科生《药物代谢动力学》理论和实验课程负责人,主持校级教改课题2项,指导国家级大学生创新项目3项,参编教材《药物代谢动力教程》,多次获得教学成果奖。主要研究疾病状态下代谢酶和转运体功能与表达调控及其对物质代谢影响,主持国家自然科学基金3项和省自然科学基金1项,近5年共发表SCI论文30余篇,其中Web of Science分区Q1杂志共计9篇,同时也有部分研究工作发表在药代动力学领域权威期刊如Drug Meta bolismand Disposition , Frontiersin Pharmacology.此外,在创新药物的药物代谢动力学和生理药物代谢动力学模型方面也有研究,主持制药企业创新药物研究合作项目6项。
正文
疾病状态下醛脱氢酶1A1活性与表达变化及其生理病理学意义
[摘要]醛脱氢酶1A1是人体19种醛脱氢酶中非常重要的一种非P450氧化酶,参与维生素A类物质代谢的第2步:将视黄醛氧化成视黄酸,避免视黄醛的细胞毒性,因此也被称为视黄醛脱氢酶1。同时,视黄醛经过醛脱氢酶1A1催化代谢的产物视黄酸也是体内重要的活性物质,通过调节维甲类受体、维甲酸受体等核受体发挥多重生理作用。醛脱氢酶1A1的表达和活性在病理状态下会发生改变,参与代谢性疾病如肥胖和糖尿病等、精神类疾病如帕金森病和阿尔茨海默病等、肿瘤如肺癌和乳腺癌等多种疾病的进程。因此,醛脱氢酶1A1可能是疾病治疗的重要靶标之一。对醛脱氢酶1A1在疾病中的变化和作用机制,其结构和催化机制,以及相关抑制剂的研发进展进行综述。
醛脱氢酶(aldehyde dehydrogenase,ALDH)是生物体内催化醇类物质代谢的一类关键酶,大量存在于动物和植物中。ALDH在辅因子氧化型烟酰胺腺嘌呤二核苷酸(NAD+)或氧化型烟酰胺腺嘌呤二核苷酸磷酸(NADP+)的作用下,可将内源性或外源性的醛代谢生成相应的酸[RCHO+NAD++H2O→RCOOH+还原型烟酰胺腺嘌呤二核苷酸(NADH)+H+;RCHO+NADP++H2O→RCOOH+还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)+H+],避免醛的毒性。此外,ALDH还可吸收紫外线,保护眼睛角膜;与甲状腺激素及对乙酰氨基酚等物质结合,发挥除催化外的其他功能。
人体内维生素A(也称视黄醇)的代谢经历2个过程:醇脱氢酶将视黄醇代谢为视黄醛;ALDH将视黄醛不可逆地氧化成视黄酸,其中由视黄醛转化为视黄酸的过程是视黄醇代谢的限速步骤。在人体中,目前已知的编码醛脱氢酶的基因有19种功能性基因(ALDH1A1,ALDH1A2,ALDH1A3,ALDH1B1,ALDH1L1,ALDH1L2,ALDH2,ALDH3A1,ALDH3A2,ALDH3B1,ALDH3B2,ALDH4A1,ALDH5A1,ALDH6A1,ALDH7A1,ALDH8A1,ALDH9A1,ALDH16A1和ALDH18A1)和若干个假基因。ALDH1A1、ALDH1A2和ALDH1A3共同参与视黄醇代谢的第2步,在成人体内,ALDH1A1尤为重要,是视黄酸的主要合成酶。ALDH1A1因为对视黄醛代谢的特异性,又被称为视黄醛脱氢酶1(retinaldehyde dehydrogenase1,RALDH1)。
ALDH1A1在多个组织器官中均有表达,主要分布于肝脏、十二指肠和胃。ALDH1A1的功能异常会影响视黄醛的代谢和视黄酸的生成,从而影响机体的生理功能。也有报道指出,ALDH1A1可以利用体内的还原性物质谷胱甘肽(glutathione,GSH)和二氢硫辛酸(dihydiolipoic acid,DHLA)将NAD+还原成NADH,NAD+/NADH的比值将影响NAD+依赖的酶的活性,影响细胞代谢和细胞生长。在ALDH1A1高表达的肿瘤细胞中,NAD+/NADH比值降低促进肿瘤细胞的生长,而候选化合物KP372-1通过增加NAD+/NADH比值发挥抗肿瘤作用。可见,ALDH1A1在维持生物体正常生理功能方面发挥着重要作用,其表达水平异常将会导致疾病发生。在疾病状态下,ALDH1A1的表达与功能发生改变,参与多种疾病进程,如肥胖、糖尿病等代谢性疾病,帕金森病和阿尔茨海默病等精神类疾病,以及与肿瘤发生发展及预后密切相关,ALDH1A1由此成为研究热点。本文对ALDH1A1在疾病中的改变、作用机制、结构以及相关抑制剂的研发进展进行综述,旨在为ALDH1A1及其相关药物的研究提供参考。
1醛脱氢酶1A1在疾病中的变化及作用机制
1.1代谢性疾病
在哺乳动物中,胰岛素信号通路异常直接介导包括肥胖、2型糖尿病在内的代谢性疾病的发生。随着对维生素A及其代谢物的深入研究,人们发现了维生素A类物质除了参与视觉调节、胚胎形成、组织分化和免疫等功能外,也参与糖和脂肪等物质的代谢调控。除视觉维持外,维生素A类物质生理功能被认为主要是由视黄酸介导的。视黄酸通过激活核受体维甲类受体(retinoid X receptor,RXR)和维甲酸受体(retinoic acid receptor,RAR)介导磷酸烯醇丙酮酸羧化激酶(phosphoenolpyruvatecarboxykinase,PEPCK)、葡萄糖-6-磷酸酶(glucose-6-phosphatase,G-6-Pase)、葡萄糖激酶(glucokinase,GCK)和固醇调节元件结合蛋白-1c(sterol-regulatory element binding proteins-1c,SREBP-1c)等关键酶的蛋白表达,参与糖和脂肪代谢的调控。动物实验研究表明,高脂饲养大鼠和糖尿病大鼠体内维生素A水平严重失衡,表现为血浆中视黄醇浓度显著降低,而肝、脂肪、胰腺和肾等组织中视黄醇水平显著增加。同时发现,糖尿病鼠和高脂饲养鼠肝视黄醛浓度降低,而肝视黄酸浓度显著增加,这种视黄醛和视黄酸浓度改变与肝ALDH活性和表达增加一致。另有文献报道视黄酸和RAR激动剂可引起大鼠血浆三酰甘油水平增加。临床报道也显示病人服用视黄酸往往伴随高三酰甘油血症等不良反应。ALDH1A1基因敲除(ALDH1A1-/-)小鼠也表现出较弱的肝糖异生和较低的空腹血糖水平,其脂肪和肝等组织中也呈现高浓度的视黄醛和低浓度的视黄酸,且高脂饲养也不易引起ALDH1A1-/-小鼠肥胖和胰岛素抵抗。此外,外源性视黄醛治疗也能改善ob/ob小鼠糖耐量和降低脂肪沉积。笔者所在课题组的研究也证实ALDH抑制剂柠檬醛能显著改善2型糖尿病大鼠和高脂饲养小鼠口服糖耐量、胰岛素耐量和丙酮酸耐量,同时柠檬醛治疗也能够逆转2型糖尿病大鼠和高脂饲养小鼠肝脏中GCK蛋白表达水平下降和PCK蛋白表达水平升高,表现出对2型糖尿病大鼠和高脂饲养小鼠体内糖代谢的改善作用。这些结果说明ALDH活性和表达增加可能参与肝胰岛素抵抗和糖尿病发生发展,而ALDH的抑制剂可以改善糖尿病症状。血糖、胰岛素、胆固醇和脂肪酸等浓度异常是糖尿病的重要特征,提示胆固醇、胰岛素和脂肪酸等浓度异常变化可能是上调ALDH活性与表达的因素。在人肝癌HepG2细胞中,笔者所在课题组发现糖尿病动物血清可诱导细胞ALDH活性,进一步分析显示胆固醇可以上调ALDH活性与表达水平。3-羟基-3-甲基戊二酸单酰辅酶A(HMG-CoA)还原酶抑制剂普伐他汀可以浓度依赖性地下调ALDH活性与表达水平,进一步佐证了胆固醇在上调ALDH活性与表达过程中的作用。有文献研究显示胆固醇可通过其代谢产物氧化胆固醇激活肝X受体(liver X receptor,LXR)/SREBP-1c通路诱导ALDH表达。胆固醇及其代谢产物氧化胆固醇,尤其是22-(R)-羟化胆固醇可以显著上调肝脏中视黄醛脱氢酶的活性。22-(R)-羟化胆固醇是LXR的内源性配体,体内胆固醇及其代谢物增加,引起LXR的活化,使SREBP-1c的表达增加,成熟型的SREBP-1c可以进入细胞核并与ALDH启动子序列SRE结合进而上调ALDH的表达和活性。胆固醇的主要代谢物胆汁酸类物质也可能参与了ALDH1A1的表达调控。脱氧胆酸(deoxy cholic acid,DCA)激动法尼醇X受体(farnesoid X receptor,FXR),诱导成纤维生长因子(fibroblast growth factor,FGF)分泌,激活成纤维生长因子受体4(fibroblast growth factor receptor 4,FGFR4),进而使丝裂原活化的细胞外信号调节激酶(mitogen-activat ed extracellular signal-regulated kinase,MEK)磷酸化水平增加,MEK磷酸化上调CCAAT增强子结合蛋白β(C/EBPβ),C/EBPβ结合在ALDH1A1启动子序列CCAAT区域,使得ALDH1A1表达和活性增加。
1.2精神类疾病
在正常人脑的黑质和腹侧被盖区的多巴胺能神经元细胞中高表达ALDH1A1,将多巴胺经单胺氧化生成的毒性代谢产物3,4-二羟基苯乙醛(3,4-dihydroxyphenylacetaldehyde,DOPAL)代谢生成无毒的3,4-二羟基苯乙酸(3,4-dihydroxyphenylaceticacid,DOPAC),因此ALDH1A1在维持脑的生理稳态中同样发挥了重要作用。在帕金森病患者腹侧被盖区的多巴胺能神经元细胞中ALDH1A1的表达虽无变化,但在黑质中的表达明显减少,ALDH1A1作为外周性生物标志物被用于帕金森病的早期诊断。Anderson等在ALDH1A1-/-模型小鼠中发现,黑质中多巴胺能神经元的生长和发育并未受到影响,酪氨酸羟化酶、多巴胺转运体及单胺转运蛋白的表达也没有变化,但是基底细胞外的多巴胺水平显著升高,黑质中表达酪氨酸羟化酶的神经元增多。在ALDH1A1和ALDH2基因双敲除的小鼠中,纹状体内左旋多巴胺(L-DOPA)和多巴胺的比率同样是升高的,这与帕金森病患者的临床表现是一致的。引起这种改变的机制尚不清楚,但以上研究证据表明ALDH活性和表达的降低,可能影响了多巴胺的重吸收和毒性产物DOPAL的代谢,也有越来越多研究表明,DOPAL参与了帕金森病的发生与发展。
Nikhil等发现在阿尔茨海默病早期患者的脑组织中,ALDH1A1活性和表达增加,而在晚期患者的脑组织中,ALDH1A1活性和表达降低。进一步的研究发现阿尔茨海默病中ALDH1A1的表达和活性改变是由细胞周期蛋白依赖性激酶(5cyclin-dependentkinase5,Cdk5)介导的。在早期神经毒性的环境中,Cdk5低表达引起的氧化应激使得ALDH1A1的转录增加;同时Cdk5通过增加ALDH1A1磷酸化使得ALDH1A1的泛素化水平下降,磷酸化会改变ALDH1A1的四聚体状态,形成高活性的单体形式,最终使体内ALDH1A1的表达和活性均增加,这种ALDH1A1表达和活性的增加作用是机体自身的一种保护机制并由此降低某些神经毒素[如4-羟基壬烯酸(4-hydroxynonenal)和丙烯醛(acrolein)等]的水平。但持续性的氧化应激最终会抑制ALDH1A1的活性,最终导致神经毒性的增加。
1.3 肿瘤
ALDH1A1在多种肿瘤干细胞(cancer stem cell,CSC)中均有表达,可与其他标志物一起,用于多种实体瘤如肺癌、乳腺癌和结肠直肠癌等和非实体瘤如白血病等CSC的分离和鉴定,ALDH1A1也可作为肿瘤预后的标志物。在多数肿瘤如肺癌、乳腺癌和结肠直肠癌等患者中,ALDH1A1高表达与不良预后相关。在结肠癌患者中,ALDH1A1高表达与原发性肿瘤低组织学分化、右半结肠定位和低总体生存率相关。在大概1/4的白血病患者中ALDH1A1低表达,这些患者表现出更好的预后和更高的总体生存率。以下主要简述ALDH1A1在2种发病率较高的癌症——肺癌和乳腺癌中的作用。
1.3.1肺癌 根据2018流行病学报告,肺癌是患病率较高的肿瘤之一,术后复发率高。ALDH1A1和造血干细胞抗原CD133、造血干细胞抗原CD44、三磷酸腺苷结合盒亚家族G超家族第2个成员(ATP binding cassette subfamily G member 2,ABCG2)常被用于肺癌CSC的分离和鉴定,ALDH1A1过表达的肺癌细胞容易产生多药耐药和转移。在人肺癌顺铂耐药株A549/DDP细胞中ALDH1A1过表达,将ALDH1A1敲除后,细胞对顺铂的敏感性增加。这可能是因为在肺癌细胞中存在由活化T细胞核因子胞浆蛋白2(nuclear factor of activated T-cells,cytoplasmic2,NFATc2)、性别决定区Y框蛋白2(sry-related HMG box2,SOX2)和ALDH1A1组成的NFATc2/SOX2/ALDH1A1功能轴。异常的NFATc2水平上调了ALDH1A1的表达,减轻了氧杂磷类、紫杉醇和铂类等化疗药物产生的活性氧类(reactive oxygen species,ROS)导致的脂质过氧化过程的醛毒性,对肿瘤细胞形成了一定程度上的保护。将ALDH1A1敲除后,该保护作用消失,从而使肿瘤细胞恢复对顺铂等化疗药物的敏感性。
1.3.2乳腺癌 乳腺癌是女性患病率较高的癌症之一,在超过一半的乳腺癌患者中,乳腺肿瘤组织中ALDH1A1和ALDH1A3的表达高于正常乳腺组织,ALDH1A1和ALDH1A3同样被用于乳腺癌CSC的分离和鉴定。在正常的的乳腺组织,ALDH1A1和ALDH1A3的表达总体处于较低水平。细胞癌变后,ALDH1A1和ALDH1A3过表达的细胞具有更强的成瘤能力。现有研究对于ALDH1A1和ALDH1A3中的哪一个在乳腺癌发生发展中占主导地位争议较大,但对于ALDH1A1的机制研究相对更多。乳腺肿瘤细胞(MDA-MB-468细胞、MCF-7细胞和SKBR3细胞)中异常增加的黏蛋白(mucin1-csub,MUC1-C),诱导细胞外调节激酶(extracellular regulated protein kinases,ERK)介导的C/EBPβ转录因子的磷酸化和激活,MUC1-C与C/EBPβ在ALDH1A1基因启动子上形成复合物,激活转录。也有文献报道异常增加的神经元位点缺口同源蛋白1(neurogenic locus notch homolog protein 1,Notch1)间接调控了去乙酰化酶2(sirtuin2,SIRT2),使ALDH1A1第353位的赖氨酸去乙酰化增加,活性增加。Ciccone等在MCF-7细胞中的研究则发现,ALDH1A1又通过视黄酸信号通路诱导了低氧诱导因子-1α(hypoxiainduciblefactor-1α,HIF-1α)和血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,促进了肿瘤微血管的形成,使肿瘤细胞的转移和浸润能力增加。综上,ALDH1A1和ALDH1A3与乳腺癌密切相关,可以与CD44、CD24等一起作为乳腺癌标志物和预后指标。但到底是ALDH1A1还是ALDH1A3在乳腺癌发生发展中占主导地位,还是在特定的情况下其中之一更为重要,则需要更多的研究资料加以证实,这对于临床上个体化给药以提高疗效或者避免严重不良反应具有重要意义。
2 醛脱氢酶1A1的结构与催化机制
ALDH1A1的相对分子质量为55000,其氨基酸残基Gly125、Gly458、Thr129、Trp178、Tyr297、Phe171、Phe466、Val174、Val460、Met175、His293等是非常重要的结合位点。酶以同源四聚体的形式存在,先形成二聚体,二聚体结合形成四聚体(人ALDH1A1四聚体3D结构可参考https://www.rcsb.org/3d-view/4WJ9/1,PDBID:4WJ9)。每个亚基都包含3个结构域:N端的NAD+或NADP+结合域、催化域和寡聚化结构域。ALDH1A1的催化机制与醛脱氢酶超家族中大多数酶(除ALDH6A1外)是一致的:辅因子NAD+(或NADP+)与N端的结合域结合,四聚体构象发生改变;醛与催化活性位点结合形成中间体并借助Asn169维持相对的稳定;随后发生电子转移,醛氧化成相应的酸的同时将辅因子还原;然后酸和NADH(或NADPH)相继被释放。发生催化反应时,仅一半的活性位点发挥作用,但是当通过特殊方式降解成二聚体时,酶的催化活性会降低。
ALDH1A1可催化视黄醛、丙醛和丙烯醛等生成相应的酸,但是具有较高的底物特异性,这可能与其四维结构相关。酶在催化位点有相对柔性的结构,亚基结构域相互作用形成一个漏斗状的催化口袋,与视黄醛结构相对契合,底物分子与之结合后构型改变,且构型改变是视黄醛氧化的限速步骤。
3 醛脱氢酶1A1抑制剂研究现状
基于ALDH1A1催化和非催化的多重作用,且在多种疾病中的表达发生改变,ALDH1A1是一个非常有潜力的药物作用靶标,其抑制剂和激动剂均有很高的研究价值。由于在多数疾病中,酶的表达和功能是上调的,针对ALDH1A1的研发以抑制剂为主。研究者致力于ALDH1A1抑制剂的研发,随着高通量技术的发展,发现了较多高选择性的ALDH1A1抑制剂。表1总结了部分在研的ALDH1A1抑制剂(1~15)。
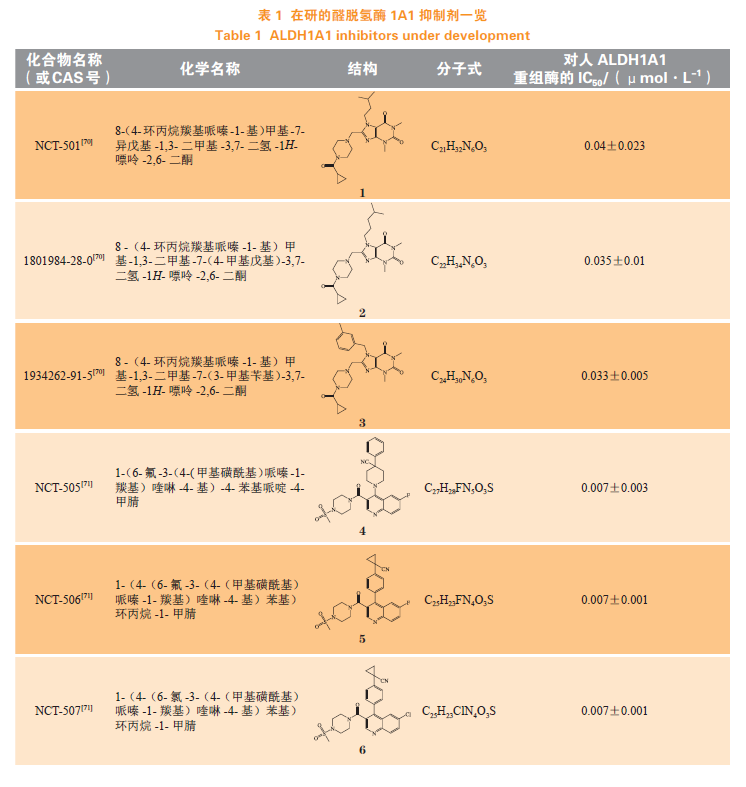
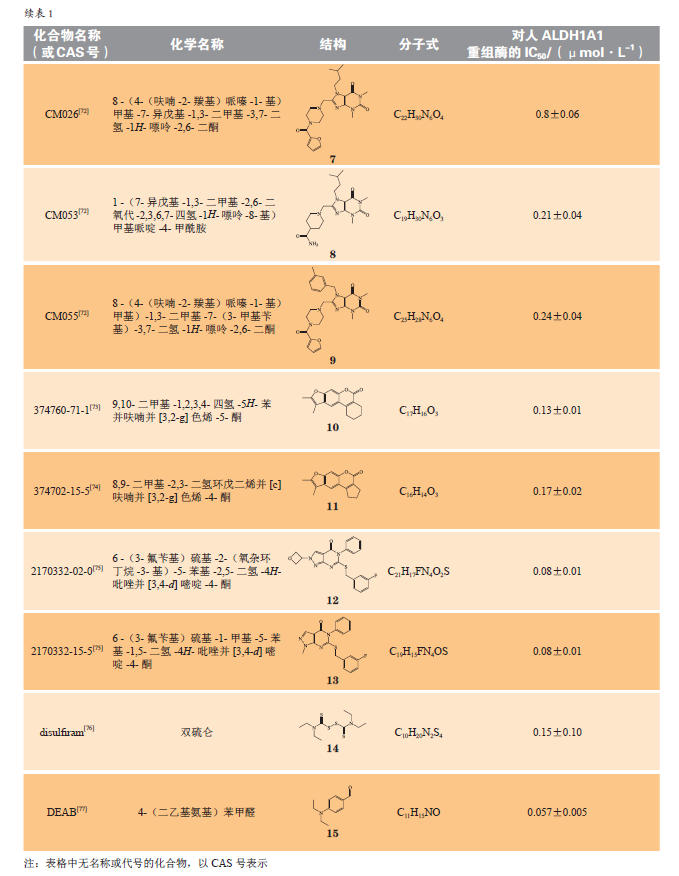
相较于早期使用的ALDH抑制剂柠檬醛,DEAB和NCT-501对ALDH1A1具有较高的选择性和抑制作用,也是目前ALDH1A1活性研究中常用的阳性对照药。NCT-505和NCT-506目前正处于临床前研究阶段,具体研究情况可https://integrity.clarivate.com/integrity/xmlxsl/查询。由于双硫仑对醛脱氢酶有抑制作用,可以明显影响乙醇的代谢,一直以来被用于治疗酒精上瘾。1971年,一名乳腺癌患者仅服用双硫仑存活了10年(死于意外事件,并非疾病死亡)且其骨肿瘤几乎消失的案例被报道,双硫仑潜在的抗肿瘤活性也引起了研究者的注意。临床前研究表明,双硫仑可以增强细胞毒性抗肿瘤药如顺铂、环磷酰胺等的作用,减少长春碱和秋水仙碱的耐药性。此后,一项关于双硫仑辅助治疗乳腺癌的Ⅱ期临床试验也表明双硫仑可提高患者的总体生存率,双硫仑辅助治疗非小细胞肺癌的Ⅱ期临床试验显示双硫仑可延长患者生存期,双硫仑与含铜药物、替莫唑胺联合给药,治疗多形性胶质母细胞瘤的Ⅱ期临床试验正在进行(ClinicalTrials.gov,编号:NCT01777919)。此外,Zdenek等对丹麦2000—2013年间超过240000名肿瘤患者的健康数据进行统计分析,结果发现,与仅在诊断前因酒精依赖使用双硫仑的患者相比,在癌症诊断前后持续服用双硫仑的患者其总体癌症以及结肠癌、前列腺癌和乳腺癌死亡率有所下降,并且在小鼠身上证实了双硫仑的抗肿瘤活性。ALDH1A1作为肿瘤干细胞标志物,其高表达往往意味着不良预后,有研究者提出了与ALDH1A1相关的抑制肿瘤干细胞生长和转移的抗肿瘤机制,也有研究认为,双硫仑抗肿瘤作用可能与泛素蛋白酶复合体系统(ubiquitin-proteasome system,UPS)被抑制、细胞内ROS改变、双硫仑代谢产物与核蛋白定位因子(nuclear-protein localization-4,NPL4)结合从而影响AAA-ATP酶P97与NPL4的结合,导致肿瘤细胞凋亡相关。目前尚无以ALDH1A1为靶点的药物上市,双硫仑与抗肿瘤药物的合用也许是肿瘤治疗的新策略。
4 结语与展望
ALDH1A1在多种肿瘤干细胞中表达增加,与其他生物标志物一起,可用于肿瘤的分离与鉴定。因此,ALDH1A1是一个非常有价值的药物靶标,针对ALDH1A1的抑制剂的研发也成为研究热点,大量抑制剂被发现和合成,针对ALDH1A1的先导化合物的优化和成药性研究或许是未来研究的方向。ALDH1A1在疾病状态下的改变以及如何参与疾病的进程也值得更多的关注,笔者所在实验室正致力于研究ALDH1A1与糖尿病的关系,已发现糖尿病状态下ALDH1A1功能和表达上调,维生素A类物质代谢紊乱,这种代谢失衡参与了糖尿病的发展,具体机制有待进一步研究。此外,新药开发周期长,成本高,双硫仑与抗肿瘤药物的合用也许是肿瘤治疗的新策略,但相关研究基本上还处于Ⅱ期临床阶段,需要更多的临床数据来支持。
来源:ppsyxjz 药学进展
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5MDY3ODExNQ==&mid=2651307896&idx=1&sn=782a22a607d05bd13f9c67184220a99c&chksm=8bf4e974bc836062faa8810942172c68a77bf14b82acb071052e2f237830cfe4a102d3107c8b&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

世界糖尿病日,盘点糖尿病领域重磅级研究成果!

新冠病毒可能令健康人患糖尿病,科学家建糖尿病监测数据库
【健康】糖尿病药物市场需求巨大
新书推荐|《中国糖尿病健康管理规范(2020)》

【健康科普】来势汹汹的糖尿病,要考虑1型糖尿病

糖尿病是如何进行分型的?除了这4种常见糖尿病,还有一种糖尿病叫1.5型糖尿病!

健康 | 什么人更容易患糖尿病?
研究揭示胆固醇代谢调控巨噬细胞抗肿瘤新机制

糖尿病防控有我|健康生活方式是糖尿病防控大门“金钥匙”
糖尿病足病