科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-12-29
来源:BioArt
在哺乳动物细胞中,绝大多数等位基因的父源和母源拷贝基本都会同时表达或关闭。然而,有一百多个基因的父源和母源拷贝的表达和关闭取决于该拷贝遗传自精子还是卵子。因为这些基因只表达父本拷贝或者只表达母本拷贝,就像是携带有父母本的印迹一样,所以也被称为印迹基因。
第一次较为严格证明基因印迹的存在始于上世纪八十年代。通过对小鼠胚胎一细胞时期父原核和母原核相互交换,英国剑桥大学的Azim Surani 和 美国Wistar研究所的Davor Solter 发现原核移植后的双父本或双母本的胚胎无法完成正常发育,证明了父源和母源基因组的功能存在差异并提出了哺乳动物中基因组印迹的概念【1-2】。这两位科学家也在去年被授予了加拿大盖尔德纳奖 (Canada Gairdner International Award) 来表彰他们在基因组印迹方面的贡献。
在上世纪九十年代早期,第一批印迹基因的发现证明了基因组印迹是在单个基因层面进行调控的【3-6】。随后进一步研究发现,许多印迹基因的父母本差异化表达是由于其附近的父母本之间DNA甲基化差异 (differentially methylated region, DMR) 造成的。通过对这些DMR在配子及胚胎发育过程中动态变化的研究发现,父母本之间的DNA甲基化差异来自于精子和卵子之间的差异,因此这些DMR也被称之为生殖细胞DMR (germline DMR)。与germline DMR不同的是,有一些父母本之间的DNA甲基化差异并非来自配子,而是在受精之后建立的,而这些DMR被称之为体细胞DMR (somatic DMR)。除了DNA甲基化的差异,印迹基因的父母本之间还存在组蛋白修饰的差异。然而,无论是somatic DMR,还是组蛋白修饰上父母本之间的差异,它们的建立都依赖于胚系DMR。这些由胚系DMR导致的父母本之间表观修饰差异的机制,能够解释目前绝大部分的印迹基因的父母本差异化表达。这一机制也被称之为经典的基因组印迹(canonical imprinting)。
然而,过去几年的研究表明,有一些印迹基因并不受来自配子的DNA甲基化调控。这些基因附近没有胚系DMR,而且它们在母源DNA甲基化缺失的胚胎或胎儿中也有正常的印迹表达【7-8】。这些印迹基因包括调控X染色体失活的关键非编码RNA Xist【9】(注:虽然有一条X染色体在雌性体细胞中是随机失活的,但在小鼠胎盘及着床前胚胎中,Xist只有父源拷贝表达并导致整条父源X染色体失活)。这些证据表明,存在一种不依赖于配子DNA甲基化的基因组印迹的机制。2017年,哈佛医学院张毅课题组在Nature杂志发文(张毅组Nature揭示基因印迹的新机制),证明母源组蛋白修饰H3K27me3调控这些不依赖于配子DNA甲基化的印迹基因,这其中包括Xist【10-11】。因为经典的基因组印迹机制主要依赖于来自配子的DNA甲基化,而这一新发现的基因印迹机制依赖于母源组蛋白修饰,所以也被称为非经典的基因组印迹 (noncanonical imprinting)。
经典的基因组印迹在发育过程中较为稳定,很多印迹基因无论是在胎儿,胎盘还是在成年体细胞中都存在父母本差异化的表达。与能够长期在发育中维持的经典基因组印迹不同,大部分非经典基因组印迹是相对短暂的。比如,在着床前胚胎中存在有几十个非经典的印迹基因,而在胎盘中,只有几个对胎盘发育有重要作用的基因能够维持印迹表达。鉴于组蛋白修饰相对不稳定性,维持这些基因在胎盘中的印迹表达的机制,我们尚不清楚。
2019年12月20日,来自美国哈佛医学院和波士顿儿童医院的张毅教授研究团队在Science Advances杂志上发表了题为Allelic H3K27me3 to allelic DNA methylation switch maintains noncanonical imprinting in extraembryonic cells的文章 (第一作者为陈志远博士),进一步阐明了非经典基因组印迹在胎盘中的维持机制。

首先,该研究对Eed 母源敲除, Dnmt3l 母源敲除 , 和Dnmt3a/3b双敲除小鼠胚胎着床前后的转录组、DNA 甲基化、H3K27me3和H3K4me3 CUT&RUN 等数据进行了相关分析。该研究发现,非经典基因组印迹在早期胚胎中是受母源H3K27me3调控的, 并且不依赖于母源DNA甲基化。母源H3K27me3在早期胚胎发育中会逐渐减弱并在胚胎着床后几乎完全消失。然而,母源H3K27me3会调控在胚胎着床期母本特异DNA甲基化的建立,即体细胞DMR。这些体细胞DMR与着床前胚胎非经典印迹基因启动子附近父本特异的H3K4me3重叠。Dnmt3a/3b双敲除小鼠胚胎不能建立体细胞DMR并表现出非经典基因印迹的缺失,这提示体细胞DMR对非经典基因组印迹在胎盘中的维持有重要作用 (图1)。
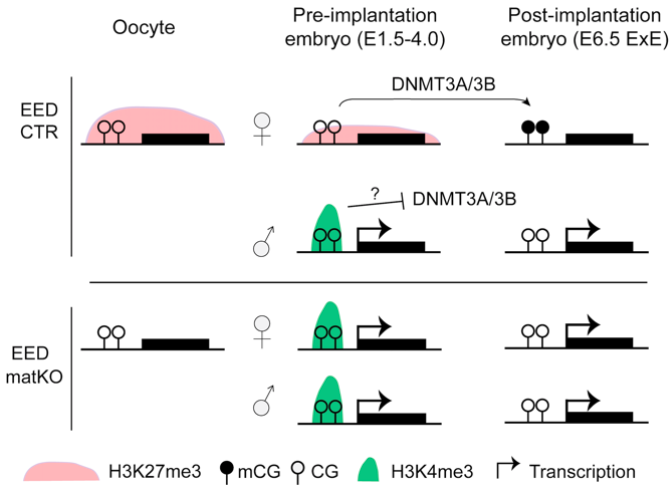
图1.维持母源H3K27me3依赖的基因组印记需要着床后胎盘中体细胞DMR的建立
总之,这项研究不仅发现了非经典基因组印迹在胎盘中的维持机制,而且证明了除了胚系 DMR之外,母源H3K27me3也能够调控体细胞DMR的建立。英国Babraham研究所的Gavin Kesley组最近也对非经典基因组印迹在胎盘中的维持机制也得出了类似的结论【12】(图2)。虽然Gavin Kelsey组没有对Eed母源敲除等相关小鼠模型进行研究,但他们发现每一个受母源H3K27me3调控的体细胞DMR都有一个ERVK内源性病毒元件,并推测ERVK内源性病毒可能是非经典印迹体细胞DMR在胎盘中特异形成的关键。
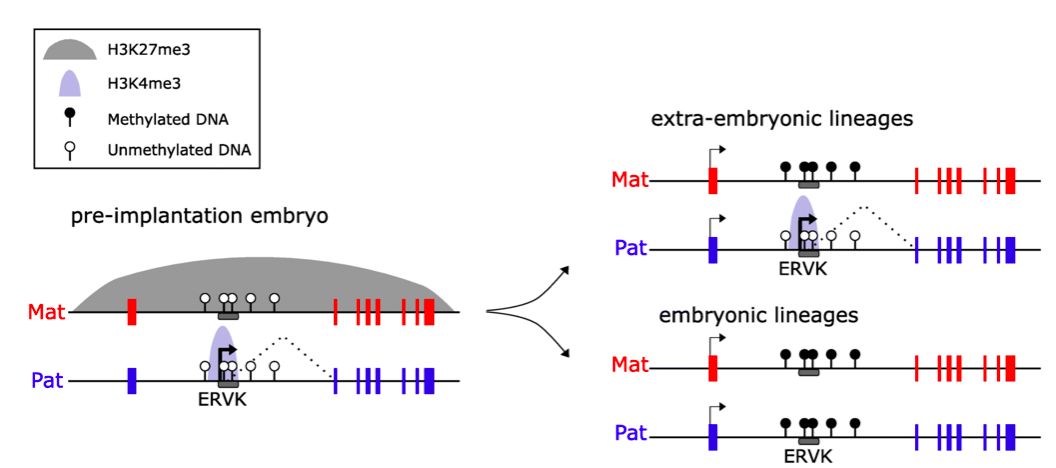
图2. ERVK内源性病毒介导的非经典基因组印迹在胎盘发育中的维持机制
原文链接:
https://advances.sciencemag.org/content/5/12/eaay7246
参考文献
1. Barton, S. C., Surani, M. A. & Norris, M. L. Role of paternal and maternal genomes in mouse development. Nature 311, 374-376 (1984).
2. McGrath, J. & Solter, D. Completion of mouse embryogenesis requires both the maternal and paternal genomes. Cell 37, 179-183 (1984).
3. Barlow, D. P., Stoger, R., Herrmann, B. G., Saito, K. & Schweifer, N. The mouse insulin-like growth factor type-2 receptor is imprinted and closely linked to the Tme locus. Nature 349, 84-87, doi:10.1038/349084a0 (1991).
4. DeChiara, T. M., Robertson, E. J. & Efstratiadis, A. Parental imprinting of the mouse insulin-like growth factor II gene. Cell 64, 849-859 (1991).
5. Bartolomei, M. S., Zemel, S. & Tilghman, S. M. Parental imprinting of the mouse H19 gene. Nature 351, 153-155, doi:10.1038/351153a0 (1991).
6. Ferguson-Smith, A. C., Cattanach, B. M., Barton, S. C., Beechey, C. V. & Surani, M. A. Embryological and molecular investigations of parental imprinting on mouse chromosome 7. Nature 351, 667-670, doi:10.1038/351667a0 (1991).
7. Okae, H. et al. RNA sequencing-based identification of aberrant imprinting in cloned mice. Human molecular genetics 23, 992-1001, doi:10.1093/hmg/ddt495 (2014).
8. Okae, H. et al. Re-investigation and RNA sequencing-based identification of genes with placenta-specific imprinted expression. Human molecular genetics 21, 548-558, doi:10.1093/hmg/ddr488 (2012).
9. Chiba, H. et al. De novo DNA methylation independent establishment of maternal imprint on X chromosome in mouse oocytes. Genesis 46, 768-774, doi:10.1002/dvg.20438 (2008).
10. Inoue, A., Jiang, L., Lu, F. & Zhang, Y. Genomic imprinting of Xist by maternal H3K27me3. Genes & development 31, 1927-1932, doi:10.1101/gad.304113.117 (2017).
11. Inoue, A., Jiang, L., Lu, F., Suzuki, T. & Zhang, Y. Maternal H3K27me3 controls DNA methylation-independent imprinting. Nature 547, 419-424, doi:10.1038/nature23262 (2017).
12. Hanna, C. W. et al. Endogenous retroviral insertions drive non-canonical imprinting in extra-embryonic tissues. Genome biology 20, 225, doi:10.1186/s13059-019-1833-x (2019).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479456&idx=5&sn=bb56de9b464c7ef6c2b781cc5c94afbf&chksm=84e20c54b3958542cd46476179c145033d444b446b459574c522f86432c8639f090fe11aefce#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
北京基因组所等鉴定出尿路上皮癌中具有预后分层的DNA甲基化亚型
“垃圾DNA”对于染色体组连接至关重要

华中农业大学教授赵书红:在基因组上“跳舞”

父母与婴儿抚触越多,或能促进宝宝身体茁壮发育
研究揭示成瘾行为形成DNA去甲基化调控机制

中国农科院(深圳)农业基因组研究所探明DNA甲基化调控猪肉性状机制

研究发现植物DNA主动去甲基化新机制

乳腺癌有望实现精准治疗,科学家揭开基因组秘密

日本科研人员发现无呼吸微生物
研究 | 成瘾行为形成的DNA甲基化调控机制