科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-04
来源:BioArt
撰文 | 阿童木
自噬(autophagy)是细胞在缺乏能量或环境胁迫条件下,产生双层膜结构以包裹自身的一部分细胞质或细胞器并运送到溶酶体进行降解的过程【1】。比利时生物学家Christian de Duve(溶酶体的发现者,1974年诺贝尔生理学或医学奖得主)于上世纪50年代首次观察到自噬体(autophagosome)的构造,并在 1963 年召开的Ciba基金会溶酶体论坛上首次提出了“自噬”这一概念【2】。经过半个多世纪的研究,学界对自噬的发生、调控及功能有了较为深入的认识,自噬在真核细胞稳态维持和自我更新中的关键作用也已得到公认。
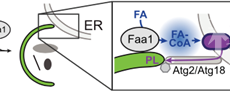
自噬过程可分为起始、延伸、成熟、自噬体与溶酶体融合和降解等5个步骤。当细胞受到内外胁迫时,胞内与内质网密切相关的自噬体前体(pre-autophagosomal structures,PASs)在Atg9等分子的调控下形成具有双层膜结构的吞噬泡(隔离膜);吞噬泡不断延伸,并在几分钟内将部分细胞质或细胞器等底物包裹成巨大的杯状结构;当吞噬泡闭合时,包裹的底物与胞质分离,形成双膜自噬体的内外囊泡;外自噬体膜与哺乳动物的溶酶体(或酵母和植物的液泡)融合,而内囊泡及其内含物暴露于水解酶中进行降解【3】。目前认为内质网、高尔基体、核内体、线粒体、质膜和脂滴等细胞器在自噬体的形成过程中发挥了重要作用【4】,但这些细胞器在哪个阶段以及在何种程度上可以直接为自噬体的形成提供膜组分仍然未知。吞噬泡迅速延伸形成自噬体这一过程中,吞噬泡的来源与聚集机制也不甚清楚。近年来研究发现,磷脂通过吞噬泡-内质网膜接触位点(membrane contact site,MCS)的转运过程很可能促进了自噬膜的组装【5】,但内质网脂质在体内是否以及如何向吞噬泡转移,及其是否涉及内质网从头合成磷脂的活性仍不清楚。长链酰基辅酶A合成酶(long-chain acyl-CoA synthetases,ACSs)是一种进化上非常保守的蛋白家族,能通过催化脂肪酸(FAs)的活化来调控细胞内脂质平衡,ACSs具有动态的亚细胞定位,因此被认为可以引导激活的FAs进入多种生化或合成途径,如脂质合成、膜编辑、蛋白质酰化和囊泡融合等【6】。
2019年12月26日,来自德国马普衰老生物学研究所(Max Planck Institute for Biology of Ageing)Martin Graef博士带领的团队在Cell杂志发表题为 “Local Fatty Acid Channeling into PhospholipidSynthesis Drives Phagophore Expansion during Autophagy” 的长文,通过研究ACS介导的磷脂代谢调节与自噬发生的关系,揭示了自噬体生物发生中自噬体膜快速广泛延伸的分子机制。

利用共表达GFP-ACS蛋白(Faa1、Faa3,、Faa4或Fat1)和mCherry-Atg8的基因修饰酵母,并结合活细胞成像手段,作者发现不同的ACS蛋白胞内定位具有明显差异,且Faa1和Faa4与Atg8在自噬体处存在共定位,该共定位有赖于核心自噬蛋白复合物装配的完整性。活细胞延时成像实验表明,Faa1被招募到核心自噬蛋白复合物有核吞噬泡的下游,该过程在时空上与吞噬泡的延伸相一致。通过巧妙地构建具有膜锚定能力的Faa1突变体(PM-Faa1)使Faa1不能被招募到核心自噬复合物上,作者发现突变细胞的自噬流显著降低,自噬过程发生严重障碍,证明了Faa1在自噬发生中的重要调节作用。此外,作者发现哺乳动物细胞ACSs家族中同样存在一种称为ACSL4的蛋白,其能定位于新生自噬体并能调节自噬流的稳态。因此,ACS蛋白介导的自噬调控是一种从酵母到人类都存在的、进化上非常保守的机制。
进一步研究表明,自噬的发生依赖于Faa1对自噬膜的催化,即自噬过程需要在自噬体上或自噬体附近具有一定的Faa1活性,Faa1介导的局部的脂肪酸(Fatty acid, FA)流动能够驱动自噬的发生。虽然核心自噬蛋白复合体在很大程度上以Faa1非依赖性的方式发挥功能,但Faa1在位于自噬蛋白复合物组装和吞噬泡成核过程下游的自噬体生物发生阶段扮演了重要角色。Faa1介导的FA局部激活能够作用于吞噬泡成核过程的下游,并启动吞噬泡的延伸,是吞噬体膜生长的限速过程,但并不会影响自噬体膜的组成。作者继续探究了FA流动是如何影响吞噬泡延伸的,发现Faa1介导的FA流动和自噬体生物合成能在饥饿胁迫下共同调节磷脂的从头合成过程,产生的磷脂会优先用于自噬体膜的组装,这也是磷脂从头合成的本质属性。
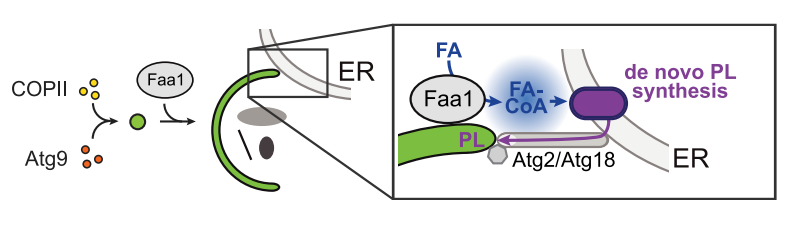
综上所述,本文通过研究细胞自噬过程中磷脂合成和流动与自噬体生物发生的关系,发现吞噬体膜的延伸是由局部的磷脂从头合成所驱动的。本研究通过阐释以新合成的磷脂为原料生成自噬体膜的分子机制,为探明自噬体的生物发生提供了全新认识,也对未来衰老和疾病发生等研究领域具有重要借鉴意义。
原文链接:
https://doi.org/10.1016/j.cell.2019.12.005
参考文献
1. Dikic, I., and Elazar, Z. Mechanism and medicalimplications of mammalian autophagy. Nat.Rev. Mol. Cell Biol., 2018, 19: 349–364.
2. Klionsky D J. Autophagy revisited: a conversationwith Christian de Duve. Autophagy, 2008, 4(6): 740-743.
3. 郑祖国, 张评浒. 细胞自噬形成机制及其功能研究进展. 中国细胞生物学学报, 2016, 38(12): 1541-1548.
4. Galluzzi L, Baehrecke E H, Ballabio A, et al.Molecular definitions of autophagy and related processes. The EMBO journal,2017, 36(13): 1811-1836.
5. Wu H, Carvalho P, Voeltz G K. Here, there, andeverywhere: The importance of ER membrane contact sites. Science, 2018,361(6401): eaan5835.
6. Coleman R A. It takes a village: channeling fattyacid metabolism and triacylglycerol formation via protein interactomes. Journal of lipid research, 2019, 60(3): 490-497.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479628&idx=2&sn=19a5b10b404f025ed3978f297c7fd455&chksm=84e23338b395ba2eb5a5b3300ea98f8a9fe252069560ccf224409c73ee1894543f75d90cf9fb&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
邱小波教授团队在PNAS 发表揭示细胞凋亡和自噬 调控机制的重要成果
磷脂双分子层
【学术前沿】Cell/Cell Res | 清华大学葛亮团队发现自噬体生物发生的重要调节新机制
羊水卵磷脂/鞘磷脂比值
非酒精性脂肪肝病———线粒体与内质网协作失败会引发严重肝脏疾病

【分析】甲状腺组织中脂肪酸和磷脂同时质谱成像分析的衍生化策略
上海有机所揭示肌球蛋白分子马达Myosin VI结合Tom1和自噬受体蛋白促进自噬体成熟的分子机制
毕俊峰博士等揭示肿瘤细胞膜脂质代谢调控的新机制和关键靶点
Cell细读 | 突破,自噬领域重大发现,磷脂合成途径是自噬体的膜磷脂来源

PNAS | 邱小波团队揭示细胞凋亡和自噬调控机制的重要成果