科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-04
来源:BioArt
在中枢神经系统中,少突胶质细胞(oligodendrocytes,OLs)形成多层膜质结构(髓鞘, Myelin)包裹和隔离神经轴突, 负责神经信号快速传导,以及发挥着营养神经、调整神经冲动同步化传导等重要的作用。髓鞘是大脑白质的主要构成成分,其发育异常以及病理性损伤都能导致严重的中枢神经系统疾病, 如多发性硬化,脑白质营养不良等。因此,研究少突胶质细胞发育、分化、髓鞘形成的生理病理机制对认知和治疗脱髓鞘疾病意义重大。
多项研究揭示少突胶质细胞的发育及髓鞘形成由多方面的分子机制在精细的时间及空间下调控完成,其中包括DNA的表观遗传修饰机制,即在不改变基因核苷酸序列的条件下,仍发生可遗传性的基因表达。在分子生物学的经典中心法则中,DNA 将遗传信息传递给RNA,然后由RNA传递给蛋白质。RNA似乎扮演着基因”传递员”的角色,并不主动参与遗传信息的表达。然而近年来,芝加哥大学何川教授团队首次发现RNA也存在着可逆性甲基化表观遗传修饰,并且可以影响基因的表达。这项发现极大拓宽了人们对基因调控的理解。
在RNA甲基化修饰中,m6A(N6-methyladenosine,6-甲基腺嘌呤)是最为常见的修饰位点。m6A的动态可逆性修饰,在转录后调控基因剪接、翻译、RNA稳定性和RNA降解等多个方面。多个研究团队也揭示了m6A甲基化修饰在不同的生物物种及多种细胞组织中发挥着重要的功能。在哺乳动物中枢神经系统中,m6A甲基化修饰对大脑灰质神经元的分化和发育,以及学习记忆等重要神经功能起着重要的调控作用【1-4】。然而m6A甲基化修饰是否影响大脑白质的发育及功能仍然处在探索阶段。
2019年12月31日,来自芝加哥大学的Brian Popko/庄小溪/李扬/何川团队以及宾夕法尼亚大学费城分校的明国莉团队共同在Neuron上发表了题为 m6A mRNA Methylation Is Essential for Oligodendrocyte Maturation and CNS Myelination 的文章。该研究利用小鼠模型选择性敲除不同发育时期的少突胶质细胞中m6A甲基化修饰蛋白(m6A writer),通过体内体外实验揭示了m6A甲基化标记在少突胶质前体细胞(oligodendrocyte precursor cells, OPCs)分化成熟为髓鞘形成细胞(myelinating oligodendrocytes),以及中枢神经系统髓鞘形成的过程中起着重要的作用。该研究进一步发现m6A标记显著影响不同发育阶段的少突胶质细胞的信使RNA剪接(mRNA alternative splicing),并且参与有髓鞘神经轴突信息传递的关键部位——郎飞结的形成。

在此项目中,研究人员首先使用meRIP-seq (Methylated RNA Immunoprecipitation Sequencing) 高通量测序技术构建了体外培养的野生型纯化OPCs以及成熟少突胶质细胞(mature oligodendrocytes)的mRNA m6A甲基化修饰谱。此图谱显示mRNA的m6A甲基化标记状态在不同少突胶质细胞发育阶段有着动态的变化。基因本体(gene ontology, GO)分析证明这些mRNA显著涉及细胞分化发育的通路。因此,研究人员使用了两个小鼠模型,分别在整个少突胶质细胞谱系(oligodendrocyte lineage),以及成熟少突胶质细胞中敲除m6A writer的重要组成蛋白Mettl14,对m6A甲基化标记在不同少突胶质细胞发育阶段的作用进行了探索。
两个小鼠模型都在成年后(4-6月)出现了中枢神经系统脱髓鞘的临床表型。有趣的是,在髓鞘发育的早期(出生后12天),Mettl14基因敲除小鼠的不同大脑白质区域就已经出现了病理性改变。免疫组化染色显示Mettl14基因敲除小鼠的大脑白质联合部位出现了成熟少突胶质细胞密度的减少,然而并未出现前体细胞OPCs的密度下降。电镜观察统计的结果显示,在Mettl14基因敲除小鼠的大脑白质中出现髓鞘厚度下降以及被髓鞘包裹轴突数量的减少。这些体内实验的结果证明了m6A甲基化标记对中枢神经系统髓鞘形成有着重要的作用。
接着,研究人员使用体外实验研究了m6A甲基化标记对少突胶质细胞的分化和发育过程的影响。分离纯化培养的Mettl14基因敲除的OPCs和野生型OPCs相比没有显著的形态及数量的变化,然而却无法像野生型OPCs那样发育成成熟的髓鞘形成细胞。这些结果证明了m6A甲基化标记对少突胶质细胞的分化成熟有着重要的作用。
该研究进一步探索了m6A甲基化标记在少突胶质细胞分化成熟过程中的机制。mRNA高通量测序显示,Mettl14基因敲除对于OPCs和成熟少突胶质细胞有着差异性的影响,有更多数量的mRNA在成熟少突胶质细胞中出现了显著性的上调或下调。结合meRIP-seq高通量测序结果,研究人员发现在OPCs和成熟少突胶质细胞中,m6A甲基化标记的mRNA涉及到多种已知的少突胶质细胞发育的基因表达调控机制,如关键转录因子的表达,DNA组蛋白修饰,以及特定细胞信号通路的分子基因表达。
mRNA选择性剪接数据分析显示,Mettl14基因敲除显著改变了多种参与少突胶质细胞发育、髓鞘形成的重要mRNA剪接,其中包括对郎飞结形成起关键作用的Nfasc。进一步的实验证明,Mettl14基因敲除的小鼠在形成郎飞结的早期,就出现了Nfasc表达的异常,以及病理性的郎飞结结构改变。
该研究揭示了m6A甲基化标记对于少突胶质细胞发育以及中枢系统髓鞘形成起着关键性的作用,为深入理解大脑白质的发育和脱髓鞘病变机制的研究提供了新的思路。
该文的第一作者为芝加哥大学神经科学项目徐焕博士;通讯作者为芝加哥大学Brian Popko教授。该项目由芝加哥大学Brian Popko/庄小溪/李扬/何川团队以及宾夕法尼亚大学费城分校的明国莉团队共同合作完成。
原文链接:
https://doi.org/10.1016/j.neuron.2019.12.013
参考文献
1. Koranda, J.L., Dore, L., Shi, H., et al. 2018. Mettl14 is essential for epitranscriptomic regulation of striatal function and learning. Neuron 99(2), pp. 283-292.e5.
2. Li, M., Zhao, X., Wang, W., et al. 2018. Ythdf2-mediated m6A mRNA clearance modulates neural development in mice. Genome Biology 19(1), p. 69.
3. Shi, H., Zhang, X., Weng, Y.-L., et al. 2018. m6A facilitates hippocampus-dependent learning and memory through YTHDF1. Nature 563(7730), pp. 249–253.
4. Yoon, K.-J., Ringeling, F.R., Vissers, C., et al. 2017. Temporal control of mammalian cortical neurogenesis by m6A methylation. Cell 171(4), pp. 877-889.e17.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479641&idx=3&sn=99c697192950690b5a4f2dffff3f1831&chksm=84e2332db395ba3b2055dc3784274fe4bcf0a95e042540c1d6c0564ab82114d072737c1791bc&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

检测癌细胞的全新技术问世
Blanc 氯甲基化反应
少突胶质细胞

Cell:人类胚胎少突胶质细胞发育与大脑皮层白质扩张的机制
氯甲基化反应
JACS:新型甲基化试剂—TEMPO-Me

当DNA甲基化遇上RNA甲基化:果实成熟的表观遗传调控 | Genome Biology

儿童营养不良,甲基化随之改变

Science:揭示蛋白QSER1保护DNA甲基化谷免受新生甲基化
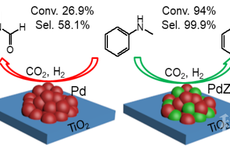
PdZn/TiO2催化剂上CO2作为甲基化试剂的N-甲基化反应