科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-07-23
抗生素是20世纪最伟大的发现之一,它一出现即带来了人类健康领域的一场革命。抗生素在对抗病菌感染时是如此高效和便利,以至于生活在抗生素时代的多数人对病菌威胁失去了警惕。然而,随着抗生素几十年如一日的大规模滥用,耐药菌感染问题不断显现。而艰难梭菌感染作为其中的典型代表,已悄然成为一个全球性的公共健康问题。 抗生素滥用和随之大量产生的抗生素耐药菌是当今全球公共健康、食品安全和经济发展的最大威胁之一,它深刻地影响着我们每一个人,无论性别、年龄和国籍。一份2016年进行的调查显示,全球每年有不少于70万名患者死于耐药菌感染。据估计,这个数字到2050年将上升到1000万人,这比所有类型的癌症死亡人数加起来(约每年800万)还要多!
抗生素滥用和随之大量产生的抗生素耐药菌是当今全球公共健康、食品安全和经济发展的最大威胁之一,它深刻地影响着我们每一个人,无论性别、年龄和国籍。一份2016年进行的调查显示,全球每年有不少于70万名患者死于耐药菌感染。据估计,这个数字到2050年将上升到1000万人,这比所有类型的癌症死亡人数加起来(约每年800万)还要多!
美国疾病预防控制中心2019年最新发布的北美耐药菌威胁报告里列出了包括碳青霉烯抗性不动杆菌、耳念珠菌、艰难梭菌、碳青霉烯抗性肠杆菌、耐药淋病奈瑟氏菌在内的5种紧急威胁耐药菌,以及数十种严重威胁和忧虑威胁的其他耐药菌。其中,艰难梭菌近年来在全球各地造成了一系列爆发性感染,自2013年起被美国疾病预防控制中心列为最高级别威胁的耐药病菌,它也可以看作是当今耐药菌问题爆发的一个典型缩影。
艰难梭菌(Clostridioides difficile)是一种专性厌氧的革兰氏阳性细菌,形状多为杆状、棒状、梭状,可产生芽孢。该菌最早于1935年由哈尔(I. Hall)和奥图尔(E. O'Toole)在健康婴儿的肠道中分离得到,因其在实验室条件下分离培养非常困难而得名“艰难”。
虽然研究者很早就发现艰难梭菌的培养物对实验动物有毒害作用,然而由于艰难梭菌最初分离自健康婴儿,且没有其他相关致病报道,于是艰难梭菌在发现后的数十年内一直被认为是正常肠道细菌之一,因而被人们所长期忽视。直到20世纪70年代,一系列研究指出艰难梭菌与伪膜性结肠炎的发生直接相关。自20世纪末,艰难梭菌感染相关疾病病例数量急剧增加,在医疗水平发达地区尤为严重,一般认为这与工业化国家抗生素滥用情况更为严重有关 [1]。至此,艰难梭菌从默默无闻逐渐走向人们关注的健康问题焦点。
艰难梭菌感染的致病机制
艰难梭菌对多种抗生素,包括氨基糖苷类抗生素、林可霉素、四环素、红霉素、克林霉素、青霉素、头孢菌素、喹诺酮类抗生素等广泛具备较高的耐药性 [2]。此外,艰难梭菌的芽孢能够抵御高温、干燥、消毒剂等各种极端条件,在自然环境中长期存活。
艰难梭菌偶见于健康人群肠道中,由于肠道正常菌群的存在,艰难梭菌通常难以定植,一般不会引发疾病。然而对于广谱抗生素、免疫抑制剂或化疗药物长期或大量使用的病人,人体正常肠道菌群遭到破坏后,容易发生艰难梭菌的侵入定植和大量繁殖,引发包括伪膜性肠炎、腹泻、肠穿孔、巨结肠、感染性休克等多种疾病症状,严重威胁生命 [2]。更重要的是,由于艰难梭菌的复合耐药特性和芽孢的存在,抗生素治疗艰难梭菌感染往往效果不佳,难以根除,许多患者在治疗结束后一段时期内会再度复发。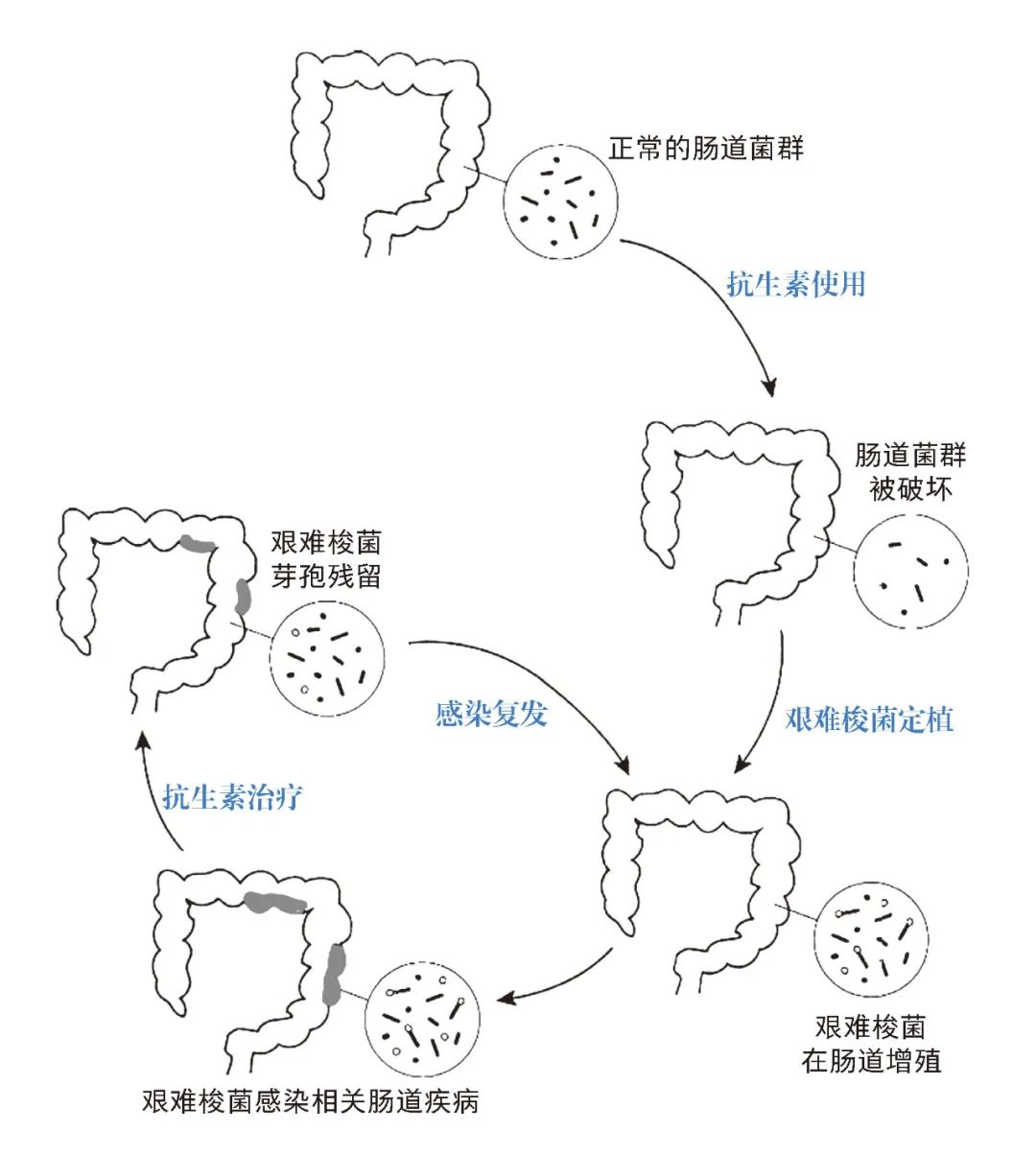
艰难梭菌感染肠道引起疾病
已知艰难梭菌可以产生3种外毒素:毒素A、毒素B和二元毒素(C. difficile transferase, CDT),艰难梭菌利用这些毒素作为“武器”来破坏人体的肠道上皮层,引发坏死和炎症,使机体出现各种疾病症状。艰难梭菌的致病能力完全依赖于其表达的外毒素,尤其是毒素B。临床发现,分离到的致病菌株几乎都包含毒素B,同时动物模型实验显示,对毒素基因进行缺失敲除后的艰难梭菌几近丧失致病的能力。因此,研究艰难梭菌毒素与宿主细胞的相互作用方式一直以来都是理解艰难梭菌发病过程的关键核心。近年来,研究者们在艰难梭菌毒素作用的分子机制方面取得了一系列突破性的进展,初步阐明了部分毒素靶向宿主细胞的底物和受体。其中,笔者所在团队鉴定了艰难梭菌毒素A和毒素B重要的宿主细胞受体 [3,4],并进一步建立了艰难梭菌毒素B的各种变异体序列的分类图谱 [5],这些研究对艰难梭菌感染临床的毒理学和病理学有着重要意义,并极大地有助于指导新的检测和治疗手段的开发。
艰难梭菌感染的流行病学研究
艰难梭菌常见于医院和社区的外源性感染和交叉感染,数据显示艰难梭菌感染导致了20%左右的抗生素相关性腹泻,以及90%~100% 的假膜性肠炎 [6]。仅2011年,美国艰难梭菌感染患者约50万人,并造成2.9万人死亡,国家经济负担约4.5亿~30亿美元 [7]。在欧洲,2018年统计数据显示,20个主要欧洲经济体国家的住院患者中艰难梭菌感染发病率高达每万人次42.9例,其中病死率约3.9%。在我国,一份2007—2008年上海复旦大学附属华山医院的统计显示,该院住院病人艰难梭菌感染发病率约每万人次17.1例 [8]。最近一项包括37663名患者的随机效应研究显示,亚洲总体艰难梭菌感染发病率与北美和欧洲相似,而与中东和南亚地区相比,东亚地区的艰难梭菌感染患病率最高。整体而言,艰难梭菌感染相关疾病已经成为一个全球性健康问题,发病态势严峻。
病原菌的基因分型对其诊断、溯源、治疗、传播途径发现和流行病学监控等具有重要的意义。对艰难梭菌分型的传统方法包括核糖体分型(ribotyping, RT)、脉冲凝胶电泳法分型、限制性内切酶分析、多位点序列分型(multilocus sequence typing, MLST)、基因组单核苷酸多态性分型等,其中RT和MLST具有较高的性价比和精确度,是目前最常用的两种分型方法。
地域间的流行菌株分布存在显著差异是艰难梭菌感染流行病学上的另一个特点。例如2002年在北美国家首先发现的高毒力艰难梭菌流行菌株,其核糖体分型为RT027,多位点序列分型ST01,可同时产毒素A、毒素B和二元毒素。临床数据显示,属于该分型的流行菌株传播性强、易引起复发、预后较差。在此之后,RT027/ST01型菌株逐渐蔓延至英国、欧洲大陆、澳大利亚、 墨西哥、 智利和韩国等地。目前RT027/ST01型艰难梭菌是北美和英国地区主要的流行菌株。亚洲地区也偶有RT027/ST01型菌株的报道,但是其聚集和爆发性与原发地差异较大,并非当地的流行株。而在中国地区,主要的艰难梭菌流行菌株为RT017/ST37、RT046/ST35、RT012/ST5、 RT078/ST11等。
此外,艰难梭菌感染发病率可能还与包括饮食在内的各种生活习惯相关。2000年后在北美等地区RT027/ST01型菌株的感染发病率普遍偏高,有研究显示可能和当地人大量使用海藻糖作为代糖有关。另外有研究提示高脂、高蛋白的饮食习惯或有可能影响艰难梭菌感染,而高碳水化合物饮食则或许会起到预防保护作用。
艰难梭菌感染的诊断和治疗
目前已经建立起艰难梭菌的临床诊断相对标准的流程。艰难梭菌检测的金标法是利用专用筛选培养基进行分离培养,艰难梭菌菌落形态扁平、粗糙、边缘不整齐,具有典型的刺激气味。接下来的细胞毒性试验,是进一步检测其是否为产毒菌株的金标手段。然而该方法的一大缺点是耗时过长,整个完整过程可能需要2~4天才能完成。相对而言,核酸扩增试验、酶联免疫法、实时链式聚合酶反应、环介导等温扩增法等方法简单快速,在灵敏度和特异性方面则各有优劣。由于实验室检测无法区分无症状携带和感染病症,疾病的诊断还需要结合临床表征,当患者满足以下两个条件时可认为是发生了感染性疾病而非无症状携带:一是出现中/重度腹泻、肠梗阻或中毒性巨结肠;二是粪便检测到产毒艰难梭菌菌体或其毒素,或者内镜下或组织病理检查显示为伪膜性肠炎 [9]。
治疗艰难梭菌感染的首要原则是隔离引起感染的危险因素。由于艰难梭菌可产生耐酒精的芽孢,日常清洁工作更应全面仔细,例如可使用肥皂替代消毒酒精进行手部清洁。因艰难梭菌感染患者多为长期住院及患有部分基础性疾病的人群,开展艰难梭菌感染治疗时应尽可能停止正在使用的广谱抗生素类药物,转而使用窄谱抗生素或者寻求其他替代药物。之后再根据患者感染的严重程度,采取分级治疗。
针对轻中度患者可采取药物治疗的方式,甲硝唑和万古霉素是目前临床推荐的治疗艰难梭菌感染的抗生素药物。患者有腹泻症状,但无其他肠炎类症状,可口服甲硝唑或经胃管给药治疗;对于内镜检查发现伪膜的患者,要配合万古霉素治疗。在接受药物治疗的过程中,患者应坚持按照标准疗程(10~14天)积极配合;避免接受治疗时,使用可诱发艰难梭菌感染的抗菌类药物,若无法避免时,可通过延长抗艰难梭菌感染药物使用时间达到更好的治疗效果;尽可能避免止泻剂的使用,其可能导致肠阻塞等更加严重的副作用;住院期间进行接触隔离,妥善处理代谢污物。对于更加严重的病患,如发现肠梗阻、肠穿孔、中毒性巨结肠,则应该考虑外科手术切除的方式,如采取的是结肠次全切除保留直肠的患者,术后可配合药物进一步治疗。接受外科手术的患者,往往病情较为严重,预后也相对较差,且结肠切除的病死率高达25%~75% [9]。
另外在临床上存在一部分病例,在完成疗程后仍反复出现复发,原因可能是患者体内细菌芽孢残留,或者因为仍处于艰难梭菌感染高风险环境中而引发二次感染。对于这类复发感染情况,抗生素治疗极难将其治愈。目前已有多种非抗生素依赖的艰难梭菌治疗手段处于不同的开发阶段,如中和毒素抗体、艰难梭菌疫苗、抗生素肠道酶解剂等。其中特别值得一提的是粪菌移植法(fecal microbiota transplantation, FMT),其展现出了令人期待的应用价值和前景。
FMT旨在通过建立新的肠道菌群,实现新的菌群—宿主相互作用以达到治疗的目的。FMT治疗过程中对粪菌供体有严格的要求,其用药史、病史、感染和常见病原体是体检时基本的筛查指标。对于受体,应根据患者情况和接受移植的途径做相应的准备,如经胃肠镜下的灌注,推荐移植前给予质子泵抑制剂以减少胃酸分泌,给予促胃动力药促进胃蠕动,缩短输注时间等。当自供体收集到符合标准的粪菌后,医疗操作人员应尽快对其进行稀释离心、过滤微滤等纯化操作,将新鲜粪菌制成可用于移植的菌液或粪菌胶囊。制备好的菌液应尽快移植至受体体内,或将菌体胶囊冷冻保藏备用。FMT的移植路径通常包括上行的口服及鼻肠管给药和下行结肠镜给药。FMT治疗难治性或反复性艰难梭菌感染有很好的效果,2013年美国将FMT纳入研究型新药管理,2016年美国食品药品监督管理局发布FMT治疗艰难梭菌感染纳入新药临床试验的新规,进一步规范约束FMT的使用,也从侧面印证了其在艰难梭菌感染治疗中的潜在价值。
艰难梭菌感染作为抗生素滥用带来的一个次生问题,已经严重威胁全球公共健康。以艰难梭菌为例的耐药菌大量出现,无时无刻不在警示我们,人类与病菌的斗争是永不停歇的。在当下时期,正确、规范、有节制地使用抗生素来延缓耐药菌的出现已经刻不容缓。同时,坚持进行有关病原菌生理和致病机制的基础研究,积极探索多种类的防治手段将是未来对抗病原菌感染的新思路。
来源:科学杂志1915
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5OTEwNzg3OQ==&mid=2650392756&idx=1&sn=6eb29e2fbaeee65e30a3b8a94a8939df
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
新型肺炎疫苗研发成功,远超23价疫苗免疫范围

抗生素中的明星分子
为什么不能滥用抗生素?
央视曝光:儿童体内检出兽用抗生素!这些常吃的食物,都可能有残留
抗生素耐药创新高,未来细菌感染还有救吗?

中国畜牧兽医学会动物药品学分会2018年学术年会在湖北武汉成功举行
抗生素你用对了吗?

科学家发现特殊细菌 竟能搭配抗生素阻止感染
母乳中的糖类或可取代抗生素治感染

滥用抗生素的最大危害