科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-07-23
高密度脂蛋白(HDL)参与维持胆固醇稳态,也可能通过它与众多血浆蛋白的相互作用而具有抗炎或抗微生物的作用。肝脏合成体内的大多数HDL,但肠道也产生HDL。然而,肠道HDL与肝脏产生的HDL发挥的不同作用还没有被确定。HDL颗粒在重塑其货物时,会在组织空间中循环,但到目前为止,HDL在组织内的转运很少被研究。
在一项新的研究中,来自美国华盛顿大学圣路易斯医学院的研究人员推断,了解HDL的转运模式可能会深入了解它在健康和疾病中的作用,包括肠道制造的HDL是否与肝脏制造的HDL在功能上是冗余的。利用他们以前产生的可在任何组织位置上对HDL进行光标记的基因敲入小鼠,他们旨在追踪肠道合成的HDL的命运。相关研究结果发表在2021年7月23日的Science期刊上。 来自小肠肠道细胞的光标记HDL在回肠产生得最多,并且没有像肠道细胞产生的乳糜微粒那样进入引流淋巴管。相反,肠道HDL迅速进入门静脉(portal vein),这是通往肝脏的主要血液供应。这一发现提出了肝脏是否可能从肠道HDL中受益的问题,并为他们指出了一个古老的概念,即HDL可能会中和一种可以从可渗透的肠道中逃逸出来的关键微生物信号:革兰氏阴性菌的脂多糖(LPS)。过去使用多种模型的研究已表明,LPS与它在肝脏中的受体---Toll样受体4(TLR4)---的接触会驱动重大的肝脏病变,包括进展为纤维化的炎症。
来自小肠肠道细胞的光标记HDL在回肠产生得最多,并且没有像肠道细胞产生的乳糜微粒那样进入引流淋巴管。相反,肠道HDL迅速进入门静脉(portal vein),这是通往肝脏的主要血液供应。这一发现提出了肝脏是否可能从肠道HDL中受益的问题,并为他们指出了一个古老的概念,即HDL可能会中和一种可以从可渗透的肠道中逃逸出来的关键微生物信号:革兰氏阴性菌的脂多糖(LPS)。过去使用多种模型的研究已表明,LPS与它在肝脏中的受体---Toll样受体4(TLR4)---的接触会驱动重大的肝脏病变,包括进展为纤维化的炎症。
利用生物化学、蛋白质组学和功能方法,这些作者观察到肠道产生一种特殊的HDL亚型,称为HDL3。与另一种HDL亚型(HDL2)不同,HDL3能有效地封存LPS,使其不能与TLR4+肝脏巨噬细胞结合。通过这种方式,肠道产生的HDL3保护肝脏免受多种小鼠肝损伤模型中观察到的炎症和纤维化,这些模型与人类的临床相关情况相似,包括小肠手术切除、饮酒或高脂肪饮食。给送一种靶向转录因子肝X受体(liver X receptor)---一种与HDL生物生成相关的基因的主调控因子---的口服药物,提高了肠道HDL水平,并保护小鼠免受肝脏病变。如果小鼠不表达来自肠道的HDL,这种保护就会消失,这表明肠道HDL是该药物的一种关键靶标。6份门静脉血样与相匹配的全身静脉血均证实了HDL3的富集。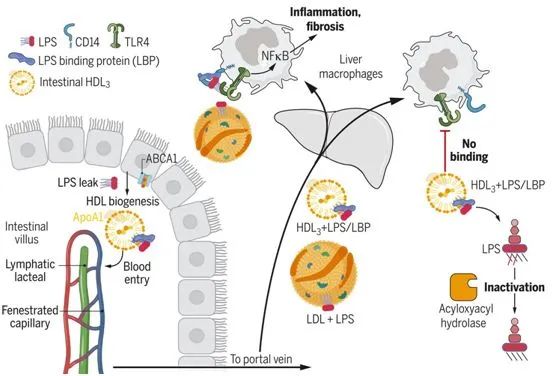
肠道HDL的转运和功能特性,图片来自Science, 2021, doi:10.1126/science.abe6729。
从机制上讲,LPS结合蛋白(LBP)在HDL3颗粒中富集,并且是HDL3掩盖LPS而不被TLR4检测所需的。这一发现是出乎意料的,因为LBP通过将LPS传送到CD14,然后CD14再将LPS传送到TLR4,从而促进TLR4信号传递。因此,HDL3与TLR4信号平台的一个已知组分---LBP---相互作用,以掩盖LPS而不被检测到。如果不与TLR4结合,HDL3-LBP-LPS复合物就不能保留在肝脏中。相反,它离开了肝脏,而与它相结合的LPS被灭活。部分上由肝脏巨噬细胞产生的能使LPS中的关键脂肪酸残基脱酰基以便激活TLR4的酰基羧酸水解酶(acyloxyacyl hydrolase)仍能访问并作用于与HDL3结合的LPS,使之解毒。低密度脂蛋白(LDL)结合LPS,但不结合LBP,因此不能阻止LPS对肝脏巨噬细胞的激活。LBP与磷脂转移蛋白和胆固醇酯转移蛋白同属脂质结合蛋白家族,它们在重塑HDL的脂质结构方面有公认的作用。另一种微生物脂质,即来自革兰氏阳性细菌的脂磷壁酸(lipoteichoic acid),已知可与LBP结合。他们发现,它也与HDL3形成复合物,并抑制肝脏巨噬细胞的激活。
综上所述,小肠肠道细胞产生的HDL可以有效地掩盖LPS,这是一种保护肝脏免受肠源性损伤的疾病耐受性策略。因此,在保护肝脏免受酒精性和非酒精性环境中的肠道来源的LPS泄漏中,肠道HDL可能是一种合适的药物靶标。
来源:生物谷
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2NjY1NjA5Mw==&mid=2247535181&idx=3&sn=2f2690d7ac3e4df8977fa82df3c81082
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Harlan M. Krumholz, MD, SM:全球范围内的胆固醇趋势

LPS1编码琥珀酸脱氢酶铁硫亚基SDH2-1,影响水稻叶片衰老和产量

NIBS邵峰团队综述细胞溶质LPS感知及其调节和病理生理功能的最新研究进展

Nat Metab:我国学者发现新冠病毒入侵的辅助受体

钟辉/曹源/陈薇/秦成峰等合作揭示新冠病毒入侵辅助受体

ATVB:较低的HDL胆固醇水平与较高的外周血白细胞计数相关

40年里,亚洲人的胆固醇升高了多少?《自然》发布超1亿人数据分析
Nat Metab:发现新冠病毒“劫持”HDL并通过SR-B1受体促进其感染
【前沿进展】 钟辉/曹源/陈薇/秦成峰等合作发现新冠病毒“劫持”HDL并通过SR-B1受体促进其感染

PNAS:郑州大学杨明/李付广揭示哮喘加重时肺部的免疫情况