科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-08
来源:BioArt
撰文 | 咸姐
责编 | 兮
小分子药物研发的巨大成功为人类健康、特别是靶向治疗做出了巨大贡献。以抗癌药物为例,传统上的小分子通过靶向结合来抑制靶蛋白酶活性,诱导癌细胞凋亡,但是,肿瘤细胞内的靶蛋白常常会恢复其活性,并通过靶蛋白的过表达或靶蛋白的新突变而获得耐药性【1】。传统小分子抑制剂的缺陷使得小分子药物日渐式微,小分子药物研发亟需引入革命性的新技术。
面对这种现象,研究人员发现了一种新的方法,利用小分子来敲除功能性靶蛋白,而不是单纯的抑制靶蛋白的活性,这种方法可以说是一项源于诺贝尔化学奖(2004年10月6日,以色列科学家Aaron Ciechanover、Avram Hershko和美国科学家Irwin Rose因共同发现了泛素调节的蛋白降解过程而被授予诺贝尔化学奖)的技术,其在一定程度上利用了哺乳动物细胞内的泛素蛋白酶体系统(Ubiquitin-Proteasome System, UPS)以分解不必要或不合适的蛋白质。这种特别设计的小分子可以“劫持”UPS,而将靶蛋白标记为降解蛋白,然后通过蛋白酶体促进降解信号,最终抑制肿瘤细胞增殖【2】,基于这一机制,蛋白质水解靶向嵌合体(Proteolysis Targeting Chimera, PROTAC)技术应运而生。从英文字面上理解,PROTAC就是靶向蛋白降解的小分子联合体,联合体分子包括三部分:一头是靶向目标蛋白的结构;另一头是可以招募蛋白降解体系比如E3连接酶的结构;中间则通过合适的连接器(linker)连接。PROTAC成为靶蛋白降解模式转换的新方式,为小分子药物的研发开辟了新的途径。
与传统的抑制策略相比,上述降解的方式有更多的优势,包括去除靶蛋白的概率增加和后续所有相关功能的消除增强。这种降解物的独特性质为分化治疗提供了机会,也为解决由以前被认为是小分子干预蛋白无法治疗的蛋白质所驱动的病理学问题提供了机会。尽管有概念上的优势,但是这种降解方法带来了更高水平的技术挑战和复杂性,而且在某些实施过程中还面临着分子特性上的问题。
正如许多重大问题的解决都离不开对其起源的探究一样,蛋白质靶向降解技术未来的发展也离不开我们对其基础的深入了解,因此,近日,来自美国新基医药(Celgene Corporation)的Philip P. Chamberlain博士和Lawrence G. Hamann博士在Nature Chemical Biology发表题为Development of targeted protein degradation therapeutics的观点,描述了他们对与结合和重新利用E3泛素连接酶的靶向蛋白质降解物相关的研究现状的看法,为我们绘制了蛋白质靶向降解技术的发展蓝图,也为其未来研究提供了方向。

本文作者指出,近年来,全球学术界和产业界对蛋白质靶向降解技术的投资兴趣大增,而这种兴趣的激增无疑源于一些关键技术的突破和融合,使得这种技术变得更容易驾驭,也更可信。
2001年,随着PROTACs一词的出现,研究者们首次对能够驱动蛋白质降解的异型双功能配体进行了描述。最初的研究主要利用肽类分子作为降解决定子,其对于体外验证和产生化学生物学工具都有一定价值,然而,事实证明,这些肽分子在体内的应用仍然具有局限性。因此,非肽类异型双功能配体的开发成为该领域发展至关重要的一步。
尽管在异型双功能降解剂的化学方面取得了实质性进展,但对于这些进展是否可应用于临床仍存在相当程度的怀疑,其主要原因在于生产具有理想的物理化学性质的分子时面对的巨大挑战,这些分子必须具有足够的结构,可以在同一分子中包含两个不同的结合基团。然而令人难以置信的是,曾经,尽管对其作用机制和直接的分子靶点知之甚少,许多药物还是获得了监管部门的批准。
直到2010年,利用沙利度胺衍生的亲和磁珠共存化得到蛋白质cereblon和DNA损伤结合蛋白1(DDB1),并证明cereblon是沙利度胺的直接分子靶标的时候,才改变了这种在不了解其分子机制的情况下进行临床前和临床研究的状况。随后的研究表明,沙利度胺及其类似物不是作为抑制剂,而是与cereblon表面结合形成蛋白质-蛋白质相互作用的热点,以产生“新形态”的活动,如招募转录因子Ikaros和Aiolos进行泛素化和降解。而继续对沙利度胺等cereblon E3连接酶调节药物(CELMoDs)的机制研究证实,它们的作用方式不同于异型双功能降解剂,而是更类似于天然产物,可以在同源连接酶-底物对之间构建蛋白质-蛋白质相互作用的支架,由此得名“分子胶”。“分子胶”的概念形象的区分了异型双功能降解物和低分子量蛋白诱导物之间的区别(图1),它们适用于不同的蛋白质靶点,受到不同的优化策略的影响,并在药理学上存在差异。
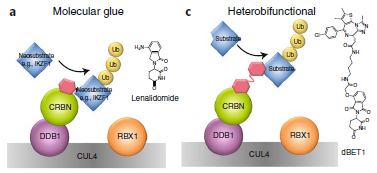
图1 分子胶(左)和异型双功能降解物(右)的结构区别
紧接着,作者为我们描述了一些在蛋白降解领域中药物研发所考虑的问题,尤其专注于结合并重新定向E3泛素连接酶以降解非天然底物的机制。
蛋白质靶向降解剂研发中第一个需要考虑的重要问题就是药理学问题。通过多结构域蛋白中的任何结构域招募E3连接酶都可以导致整个蛋白质的降解,而且,随着降解导致的一个蛋白所有功能的消失,将会有很多机会来攻击那些因非催化功能致病的蛋白质;E3连接酶招募目标蛋白质的另一个有效作用是泛素连接酶的酶促活性,并且能够快速地对底物转换率高的靶蛋白进行泛素化修饰。与此同时,与传统的可逆性小分子抑制剂随着药物浓度减少而逐渐失去效力相反,靶标降解将有望推动持续的目标抑制和强大的生物效应,但这也涉及了有关靶蛋白重新合成速率的考量。
虽然分子胶和异型双功能降解物之间有很多共同的优点,但也存在着药理学差异。异型双功能分子对连接酶和底物的双重亲和力也意味着配体能够独立地与每个靶蛋白结合,这就将导致在高配体浓度时二元复合物的饱和,并与E3连接酶-底物-配体复合物的形成产生竞争性,从而使得降解活性减弱,成为“hook”效应,而CELMoDs对于自由底物没有亲和力,因此也不存在这个浓度依赖性问题。
第二个需要考虑的问题在于不同连接酶的选择。已知大约有600个E3泛素连接酶可以调控蛋白酶体的功能,这就为蛋白质靶向治疗提供了无限机会。由于靶向蛋白降解的整个过程依赖于配体诱导的接近性,因此E3泛素连接酶与靶蛋白在时空上的共定位是至关重要的,组织表达、亚细胞定位和调控的差异都可能带来潜在的陷阱和机会。
第三个问题即治疗差异化。传统的可逆抑制剂以一种简单的方程式描述与靶标的结合,但是,与之相反,降解剂则需要一个多步骤的过程,除了简单的配体-靶标相互作用外,还需要额外的细胞因素,这其中最关键的一步就是靶标、小分子配体和E3泛素连接酶之间形成三元复合物。作者相信,随着降解小分子的进一步开发,人们将了解细胞机制在分子、连接酶、组织、生物体和患者群体中的共享程度。对多种细胞成分的依赖也增加了研发过程的复杂性,并可能为临床耐药性提供多种途径,然而,同样的复杂性也导致了治疗的差异性。
除了重新利用不同连接酶存在的生物学差异外,目前可用的连接酶之间还存在着一些物理化学方面的差异,如何获得合适的物理化学性质以及吸收、分布、代谢和排泄(ADME)特性,使之足以口服给药和/或甚至达到中枢神经系统是极其重要的。而现今还没有出现一个系统的分子配对分析系统,可以定量评估最终降解剂的物理化学和ADME性质在不同的靶标结合部分和连接物的许多不同背景下的总体影响,从而指导设计原则以最大限度地提高体内的药代动力学和功效。
综上所述,本文的作者为我们详细阐述了蛋白质靶向降解技术发展的历程,也指出其发展过程中不可忽略的重要问题,同时提出,两类PROTAC——异型双功能蛋白降解剂和“分子胶”,虽然都具有类似的优点,但是它们之间的分子差异意味着它们的应用范围、化学和药理学性质也存在着差异,因此它们在临床的扩展和应用领域也不同,而随着蛋白质靶向降解技术的巨大潜力的开发,最令人兴奋和最引人注目的地方,就在于其有机会将多种曾经药物不可作用的蛋白质组用于治疗,蛋白质靶向降解疗法的应用前景将是不可估量的!
原文链接:
https://doi.org/10.1038/s41589-019-0362-y
制版人:珂
参考文献
1. Salami, J.; Crews, C.M. Waste disposal-An attractive strategy for cancer therapy. Science, 2017, 355, 1163-1167.
2. Wang P, Zhou J. Proteolysis Targeting Chimera (PROTAC): A Paradigm-Shifting Approach in Small Molecule Drug Discovery. Curr Top Med Chem. 2018;18(16):1354-1356.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479711&idx=5&sn=76e9f6d40c689f0e123349795f1b7b98&chksm=84e2336bb395ba7db949b93e870b84e9af75ed829bcc4636e8742742511fc9c86bd73bd7beae&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
韩国称合成出可识别新冠病毒抗体的蛋白质

吃了这么多年鸡蛋,才知道这10种蛋要少吃!第一个你就经常吃

关于蛋白质合成的相关研究

韩国称合成出可识别新冠病毒抗体的蛋白质
蛋白质之间发生了什么?
香港大学:合成新工具剖析细胞蛋白质互动网络
首次证明!修复蛋白质合成错误能延长寿命

Cell: 细菌核糖体如何修复蛋白质错误合成
生物物理所发现宿主抑制病毒蛋白质合成重编码的新机制
研究人员直接观察RNA控制蛋白质合成