科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-11
来源:BioArt
责编 | 兮
微管是调节细胞形状,驱动有丝分裂,提供细胞内转运平台并介导细胞运动的细胞骨架元素。α和β微管蛋白形成专性异二聚体后聚合形成了微管。这个聚合的过程是可逆与动态的,很大程度上受到游离(即非聚合的)微管蛋白浓度的影响。大约40年前,美国的研究人员注意到细胞似乎在监测自身有多少游离的微管蛋白,并自动根据其浓度调节微管蛋白mRNA的水平【1】。当细胞检测到游离微管蛋白浓度增加时,它们会通过一个自动调节的过程触发微管蛋白mRNA降解。但这一调控具体的分子机制一直没有明确。
近日,来英国剑桥分子生物学实验室Ramanujan Hegde博士带领的团队在Science杂志上发表了题为“TTC5 mediates autoregulation of tubulin via mRNA degradation”的研究论文。林哲望博士为文章的第一作者。该研究发现TTC5在游离微管蛋白过量时,会与核糖体上翻译的α和β微管蛋白的新生多肽链结合,从而触发其mRNA的降解。该研究描述了一种细胞通过识别新生多肽链的特异性因子将特定的mRNA的进行靶向调控的新机制。

细胞严格控制着一些关键的看家因子的蛋白丰度,以将其维持在稳态所需的最佳水平。大多数丰度控制机制都涉及对mRNA转录的反馈调节,但是其他诸如微管蛋白的调节机制则由高度特异性的mRNA降解来调节。1980年代关于微管蛋白自动调节的机理研究发现,只有在翻译中的微管蛋白mRNAs才会受到这一自动调节的调控【2】。另外,微管蛋白翻译过程中出现的前四个氨基酸(Met-Arg-Glu-Ile,MREI)对此自动调节起到了至关重要的作用【3】。后续的工作进一步发现,与β-微管蛋白N端多肽序列结合的单克隆抗体会破坏其自动调控【4】。基于这些发现,人们认为有一个蛋白因子通过识别微管蛋白N端的氨基酸序列与其新生多肽链结合,从而启动正在翻译的微管蛋白mRNA的降解。但30年来,这一蛋白因子一直未被发现。
研究人员首先利用定点UV交叉链接的实验策略来捕捉这一蛋白因子(图 1A) 。研究人员使用兔网织红细胞裂解液在体外翻译了β-微管蛋白mRNA的分段, 产生了核糖体和微管蛋白前94个氨基酸的新生链复合体(RNC),并在此翻译过程中利用琥珀突变抑制基因的方法在靠近多肽N端处引入非天然的UV交叉链接氨基酸(对苯甲酰基-L-苯丙氨酸,Bpa)。在紫外线照射下,β-微管蛋白新生多肽和其结合的蛋白质产生交联。其中,只有一个交联对MREI基序的残基2、3和4的突变敏感(图 1B) 。随后作者用蛋白质组质谱分析的方法鉴定出了该MREI特异交联蛋白为TTC5,并通过其抗体的免疫沉淀确认TTC5与α和β-微管蛋白新生多肽形成交叉链接。这表明TTC5能同时调控α和β-微管蛋白的mRNA。由于微管蛋白的前四个氨基酸序列(MREI或者MREC)只存在于α和β-微管蛋白,这就解释了为什么只有微管蛋白的mRNA受到此自动调节的调控。
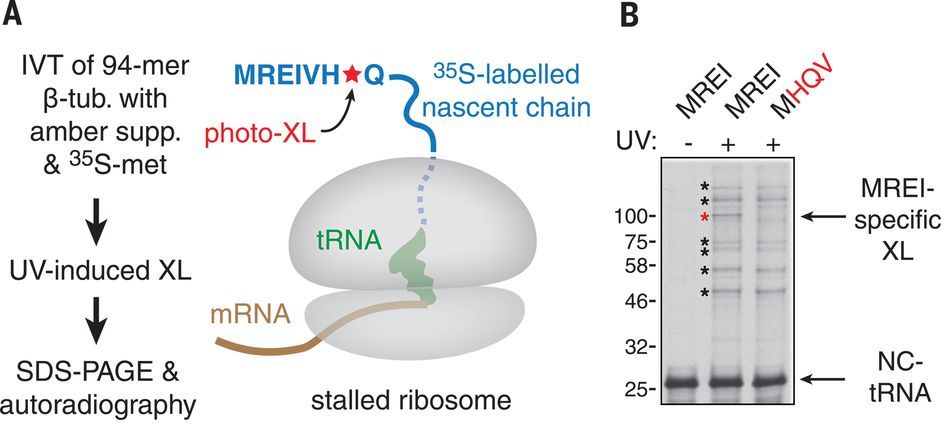
接下来,作者通过单粒子冷冻电子显微镜确定了核糖体-微管蛋白新生链-TTC5复合体的结构。结构表明了TTC5如何在核糖体出口通道附近与从核糖体翻译后不久的新生微管蛋白结合:微管蛋白新生链N端与TTC5的TPR结构域的深沟结合,而TTC5的OB结构域则与核糖体的28S rRNA主链以及核糖体蛋白uL24两个位点接触。作者进一步利用TTC5的突变体与RNC交联分析验证了Arg147,Asp225和Glu259分别是与新生微管蛋白的Arg2和Glu3相互作用的残基,而Lys285和Lys287则是与核糖体的28S rRNA结合的关键残基。总的来说,TTC5同时与核糖体和新生微管蛋白多肽链相结合,该结构很好地解释了TTC5对正在进行翻译的微管蛋白mRNA所具有的极高亲和力和特异性。
在多种细胞内的实验表明,CRISPR介导的TTC5基因敲除完全消除了细胞对α-和β-微管蛋白mRNA的自动调节。在TTC5敲除的细胞内,微管蛋白的自动调节可以通过野生型TTC5的表达完全恢复。同时,不能与微管蛋白新生多肽或核糖体结合的TTC5突变体则无法恢复自动调节。因此,当细胞启动自调节时,新生微管蛋白与在核糖体上的TTC5结合是微管蛋白mRNA降解的必要条件。最后,作者发现微管蛋白自动调节对于细胞有丝分裂时保持忠实的染色体分离至关重要。在没有TTC5的情况下,染色体分离错误会增加。
综上所述,TTC5代表一种受调节、具有高度选择性的核糖体相关因子,仅能与正在翻译α和β-微管蛋白的细胞核糖体结合。通过标记正在翻译微管蛋白的核糖体,TTC5可以在该位置上募集下游的效应分子,从而触发mRNA降解。从更广泛的层面上来说,翻译中的核糖体提供了控制细胞蛋白丰度的平台:翻译的起始,延伸,多肽的命运和mRNA稳定性均可由此平台进行局部调节。本文所建立的方法和范例为研究此类调控模式提供了框架。
原文链接:
https://science.sciencemag.org/content/367/6473/100
参考文献
1. D. W. Cleveland, M. A.Lopata, P. Sherline, M. W. Kirschner, Unpolymerized tubulin modulates the levelof tubulin mRNAs. Cell 25, 537-546 (1981).
2. D.A. Gay, S. S. Sisodia, D. W. Cleveland, Autoregulatory control of beta-tubulinmRNA stability is linked to translation elongation. Proc Natl Acad Sci U S A 86,5763-5767 (1989).
3. T.J. Yen, P. S. Machlin, D. W. Cleveland, Autoregulated instability of beta-tubulinmRNAs by recognition of the nascent amino terminus of beta-tubulin. Nature 334, 580-585 (1988).
4. N.G. Theodorakis, D. W. Cleveland, Physical evidence for cotranslationalregulation of beta-tubulin mRNA degradation. Mol Cell Biol 12,791-799 (1992).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479820&idx=1&sn=8e8e7401555a0cc6bf006ba18abcef3d&chksm=84e232f8b395bbee6fc981642d3d81c150925ba97fec3ae70309252536d70d91b615b7ef040e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
科研人员解析核糖体组装的动态过程

关于人源核糖体大亚基前体复合物结构的报道
生物物理所发现宿主抑制病毒蛋白质合成重编码的新机制

新研究揭示核孔复合体转运核糖体前体的分子机制

没有细胞,怎么养核糖体?
核糖体合成抑制剂可成为癌症治疗备选方法

Neuron | 陈一茗等开发核糖体标记神经胞体成像技术
从 “黑洞”表型着手,首次发现果蝇多倍体细胞具有核周微管组织中心

科学家首次观测到核糖体组装过程

第166期泰山科技论坛——科技成为牡丹的“真国色”