科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-08-20
来自美国耶鲁大学的研究人员于2020年12月在Biological Psychiatry 发表综述,详细介绍了氯胺酮的药理作用机制,并且特别强调了突触连接及其脑网络效应在临床抑郁症病理和治疗中的作用。
1.氯胺酮的突触作用:
增加细胞外谷氨酸和mTORC1依赖的突触形成
氯胺酮是一种使用依赖的NMDAR开放通道阻滞剂。NMDAR是一种离子型谷氨酸受体,允许阳离子通过,是突触可塑性的重要介质。NMDARs的功能与AMPA受体(AMPAR)关系密切。AMPAR介导的突触后膜去极化导致NMDAR通道孔开放,这是氯胺酮进入和阻断NMDAR通道的必要前提。
虽然氯胺酮是一种NMDAR通道阻滞剂,但低麻醉剂量的氯胺酮会导致啮齿动物内侧前额叶皮质(mPFC)中细胞外谷氨酸水平在几分钟内迅速增加,而这种谷氨酸激增与突触形成相关。
研究发现单次亚麻醉剂量的氯胺酮会增加突触前和突触后蛋白质的表达水平,包括突触蛋白1、PSD95和mPFC中AMPAR的GluA1亚基。
电生理学和形态学的研究结果表明,单剂量的氯胺酮可增加mPFC中V层锥体神经元上树突棘的数量和功能。
影响突触可塑性的关键下游信号是mTOR复合物1(mTORC1)。mTORC1通路受多种刺激的调节,包括神经元活动、神经营养因子信号、氨基酸水平和能量需求。单剂量的氯胺酮迅速激活mTORC1信号。此外,实验中同样发现神经营养因子也是氯胺酮的抗抑郁药理机制中的关键一环。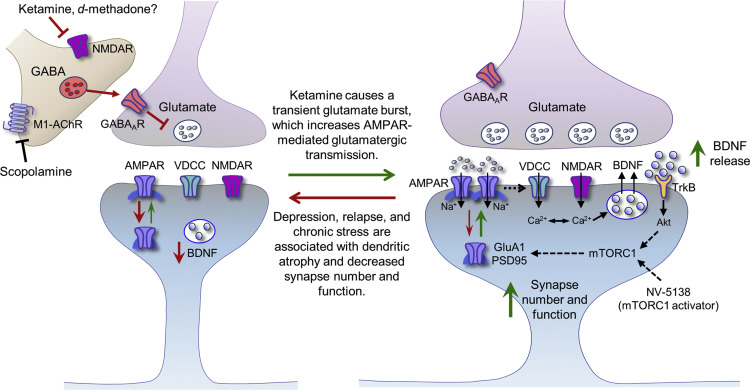
图1 氯胺酮介导的内侧前额叶皮层锥体神经元去抑制和随后的突触变化的示意图模型
2.氯胺酮抗抑郁作用的初始细胞触发:
去抑制和直接抑制
该领域的一个主要问题是氯胺酮如何增加细胞外谷氨酸,以及快速突触和行为反应的基础是哪种初始细胞触发。
新皮质和海马由异质性神经元群组成,包括谷氨酸能主神经元和GABA能(γ-氨基丁酸能)抑制性中间神经元,它们共同维持着兴奋和抑制的微妙平衡。然后实验发现,麻醉课题的氯胺酮会抑制两种细胞的兴奋性,而亚麻醉剂量则会促进兴奋。
一种推定的机制假说亚麻醉剂量的氯胺酮可以是选择性阻断GABA能中间神经元上的NMDAR,导致谷氨酸神经传递的“间接”去抑制。啮齿动物的体内电生理记录以及双光子钙成像结果均支持该去抑制假说。
这些发现与mPFC中GABA能中间神经元活性的抑制足以产生持续的抗抑郁样作用并增加锥体神经元兴奋性突触后电流的研究结果一致。
第二个假设认为氯胺酮直接作用于mPFC和海马中的谷氨酸能锥体神经元,并抑制由谷氨酸自发释放引起的突触后NMDAR活动,从而引发快速和持续抗抑郁反应所需的细胞内信号级联反应。
研究发现,氯胺酮阻断静息状态下NMDAR使真核延伸因子2(eEF2)激酶(eEF2K或CaMKIII)失活,导致eEF2磷酸化减少、BDNF的翻译和释放增加以及随后海马CA1的突触增强锥体神经元。
另外,研究表明蛋白质合成抑制剂放线菌素D进行预处理可防止氯胺酮诱导抗抑郁样行为,而选择性eEF2K抑制剂可增加BDNF蛋白表达并产生快速抗抑郁反应。
3.氯胺酮对其他神经递质系统的影响
及其在抗抑郁反应中的作用
除了谷氨酸,氯胺酮还会影响与情绪和动机相关的多种神经递质系统的水平,包括GABA、多巴胺和血清素。
临床前研究结果表明,慢性压力会导致GABA能神经传递的缺陷,而氯胺酮可逆转这些缺陷。此外,代谢组分析表明,氯胺酮的预防性治疗增加了抑制性神经递质的大多数前体,同时减少了应激小鼠PFC和海马中兴奋性神经递质的大多数前体,这表明预防性氯胺酮可能通过调节GABA能和谷氨酸能神经传递来增加压力恢复能力。
而在具有抑郁表型的动物模型中,氯胺酮可重置mPFC中的兴奋性和抑制性神经递质,从而纠正两个系统的缺陷。
氯胺酮在治疗抑郁症患者的动机功能障碍(如快感缺乏症)方面特别有效,脑成像研究强调了多巴胺奖赏回路在氯胺酮抗抑郁作用中的潜在重要性。
啮齿类动物的临床前研究表明,亚麻醉剂量的氯胺酮会刺激腹侧被盖区的多巴胺神经元,并导致mPFC中多巴胺的细胞外水平快速而短暂的增加。
多巴胺D1受体(Drd1)的激活增加了NMDARs和AMPARs的表面表达并促进了mPFC锥体神经元的兴奋性和兴奋性突触输入,这可能有助于氯胺酮诱导的突触形成和增强。
这些发现表明,氯胺酮的抗抑郁作用需要mPFC中谷氨酸能和多巴胺能系统之间的相互作用。
最近的研究还证明了5-羟色胺系统在氯胺酮抗抑郁作用中也具有重要性。单次亚麻醉剂量的氯胺酮会迅速增加mPFC中的细胞外5-羟色胺(5-HT)水平,并且,选择性5-HT1A受体激动剂注入mPFC会产生氯胺酮样行为效应并刺激mPFC中的mTORC1信号传导和突触蛋白表达。
这些研究结果均表明mPFC中AMPAR依赖性5-HT的释放和随后突触后5-HT1A受体的激活在氯胺酮的抗抑郁作用密切相关。
4.氯胺酮快速抗抑郁作用的大脑区域和回路
临床前研究已经开始揭示介导氯胺酮快速抗抑郁作用的大脑区域和回路。Fuchikami等人进行的初步研究证明了将氯胺酮注入mPFC就足以产生快速和持续的抗抑郁作用,而全身性氯胺酮的行为效应可以通过向mPFC注入GABA受体激动剂Muscimol来消除。
另外研究还发现,光遗传刺激mPFC下缘的锥体神经元产生快速而持久的抗抑郁药样效应,这些效应与mPFC第V层锥体神经元突触的数量和功能增加有关。
根据神经投射靶点以及形态学、电生理和药理学特征,至少鉴定出两种类型的mPFC锥体神经元,它们分别表达Drd1或Drd2基因。
mPFC中表达Drd1的神经元的光遗传学激活再现了类似于氯胺酮的快速和持续的抗抑郁样反应,并且在氯胺酮全身给药时,mPFC Drd1神经元的光遗传学或化学遗传学抑制会阻断氯胺酮的抗抑郁作用。
相反,光刺激mPFC Drd2的神经元的不产生抗抑郁样作用,并且抑制mPFC Drd2神经元不会阻断对氯胺酮的抗抑郁作用。
除了上述mPFC的输出外,最近的研究报告了mPFC的输入同样是氯胺酮的快速抗抑郁样作用的基础。研究表明,用利多卡因灭活腹侧海马可以阻断氯胺酮的抗抑郁作用。
另外,代谢型谷氨酸受体mGluR2和mGluR3 NAMs可增强丘脑皮质谷氨酸能传递,并在慢性应激小鼠中产生快速的抗抑郁样作用。
也有研究表明外侧缰核(LHb)在氯胺酮的作用中起作用。LHb是连接前脑和中脑单胺能核的通道。Yang等人证明,在先天性习得性无助的大鼠和慢性束缚应激后的小鼠中,LHb神经元的突发性放电增加,氯胺酮可以逆转LHb的突发性放电。
NMDAR和低电压敏感的T型钙通道共同推动突发性放电的增加,局部阻断LHb中的NMDAR或低电压敏感的T型钙通道就足以产生快速的抗抑郁药样效应。
这一机制与氯胺酮的快速作用有关,但考虑到24小时的抗抑郁作用未被研究,LHb是否也参与了氯胺酮的持续作用尚不清楚。
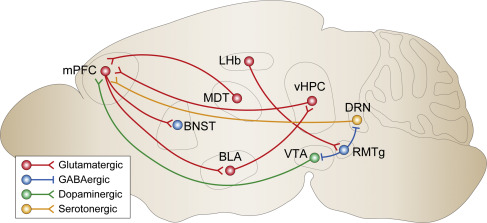
图2 参与氯胺酮抗抑郁作用的神经回路
结 论
氯胺酮速效抗抑郁作用的偶然发现为各项研究工作提供了独特的角度,杜曼实验室和其他优秀实验室的开创性临床前研究已经确定了各种推定的药理机制和治疗目标,并已经对具有新机制的新药进行临床测试,例如右美沙酮(REL-1017)。
此外,许多这些临床前假设获得了支持性临床证据,并对我们更加深入地了解抑郁症和其他与压力相关的精神疾病的发病机制和治疗手段。
来源:brainnews
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649603429&idx=1&sn=529211e3f7be664f0687a9f0df02cc5a
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

氯胺酮干扰工作记忆的新证据
氯胺酮为何是一种抗抑郁药?

中国电子学会发布新一代人工智能领域十大最具成长性技术展望(2018-2019年)

评论:是时候该应对AI与神经科技带来的伦理问题了
我科学家揭示氯胺酮快速抗抑郁的分子机制
学习新任务时,大脑没有想象中那么灵活

『主编手记』 不懈的动力

上海科学家如何发现氯胺酮抗抑郁机制关键靶点
Nature : “糖瘾”的神经生物学基础

氯胺酮或能减少饮酒