科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-08-20
2021年8月17日,The Plant Cell在线发表了韩国首尔国立大学生物科学系Hyung-Taeg Cho团队题为“CALCIUM-DEPENDENT PROTEIN KINASE 29 modulates PIN-FORMED polarity and Arabidopsis development via its own phosphorylation code”的研究论文。该研究发现钙依赖性蛋白激酶CPK29直接靶向磷酸化PIN-FORMED(PIN)蛋白的亲水环,以调控其胞内运输和拟南芥发育。
研究背景
PIN生长素外输载体在质膜(PM)表现出明显的极性定位,并是生长素极性运输(PAT)和梯度建立的关键介体。PIN蛋白由一个中心亲水环(HL)和两个疏水区域组成,HL结构域的翻译后修饰,如磷酸化和泛素化,对于细胞内PIN的极性运输和活性调控具有重要作用。迄今为止,已鉴定发现至少有三个蛋白激酶家族参与PIN-HLs磷酸化调控,包括AGC型蛋白激酶、MPKs和钙依赖性蛋白激酶(CPK)相关激酶CRK5。然而,胞内PIN极性和PAT受到各种内部和外部信号的影响,因此,PIN-HL的调控因素及其反式作用因子可能更加复杂多样,这些过程的潜在调控机制仍需进一步探索。
主要内容
以PIN2-HL为诱饵进行互作蛋白筛选,由此鉴定出CPK29,CPK29同时也与PIN1和PIN3的HLs结合。体外磷酸化分析显示,CPK29不仅能够自体磷酸化,而且可直接磷酸化PIN1/2/3 HLs,Ca2+对磷酸化活性具有增强作用。蛋白组分分析以及荧光观察发现,CPK29主要定位于PM。
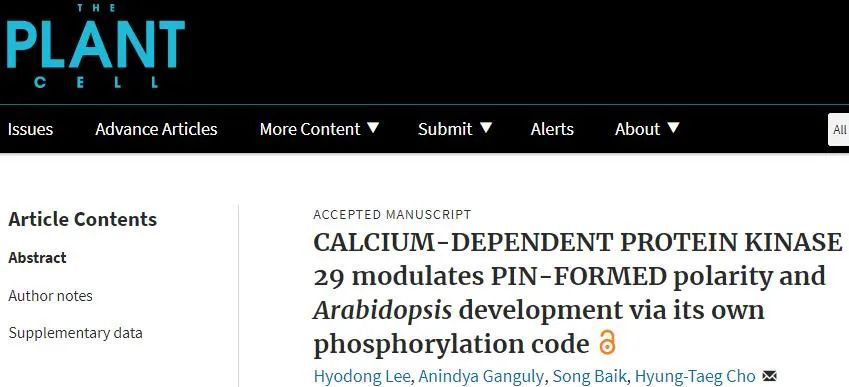
在cpk29-2突变体中,PIN的胞内运输和极性发生明显缺陷。对CPK29靶向PINs的磷酸化残基(PIN1 S253A和PIN2 S259A)进行突变,其结果与cpk29-2类似。通过内吞示踪荧光染料FM4-64共定位分析表明,cpk29-2细胞中内化的PIN2蛋白主要定位于早期核内体,CPK29影响PIN的内体运输。另外,胞外囊泡转运抑制剂BFA是评估PM和核内体之间蛋白再循环速率的有利工具。BFA处理后,PIN1和PIN2在WT中的内部积累明显快于cpk29-2。BFA去除后,WT中PINs从内体到PM的转运明显快于cpk29-2,表明CPK29促进PINs的胞外转运。利用WT和磷酸化缺陷/模拟PINs进行BFA实验得到相似的结果,这说明保守的CPK29靶标磷酸化残基参与PIN1和PIN2的胞外运输。进一步对PIN转运进行分析表明,CPK29介导的PIN2-HL磷酸化促进了PIN2至PM的转运(图1),并且该过程需要Ca2+信号的参与。
图1. CPK29靶标残基的磷酸化促进PIN至质膜的再循环
CPK29介导的PIN转运和极性调控说明它可能影响局部生长素梯度建立以及生长素相关的发育过程。对cpk29突变体和PIN2-HL磷酸化位点突变表型进行观察和分析发现,PIN介导的生长素再分配和相关生物过程均发生缺陷,包括侧根形成、根弯曲、下胚轴向重力性、叶序和生殖发育(图2),表明CPK29对于PIN介导的发育过程至关重要。

图2. PIN1中CPK29的靶标残基对于PIN1介导的生殖发育至关重要
来源:植物科学最前沿
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

改革开放40年丨通车里程全球第一,路网密度突飞猛进!
开发出酪氨酸磷酸化监测新方法
酪氨酸磷酸化抑制剂23
蛋白质酪氨酸磷酸化的分子识别研究

化学小分子诱导靶标蛋白质去磷酸化

李国清/柳亦松合作报道裂头蚴磷酸化修饰图谱

独辟蹊径,Theranostics:胃镜活检癌组织样本的磷酸化组学分析
光合磷酸化作用
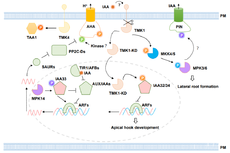
综述:生长素途径中的蛋白可逆磷酸化机制

辽宁省抚顺市交通事业发展服务中心正式挂牌成立