科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-08-26
内源环形RNA的降解机制是环形RNA研究领域的难解之谜。其中,内含子来源的环形RNA(ciRNAs)是一类由于前体RNA剪接过程中内含子套索不能正常脱分支而稳定存在于细胞内的共价闭合RNA分子。
中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)、国科大杭州高等研究院陈玲玲研究组发现一部分内含子来源的环形RNA以DNA-RNA hybrid (R-loop)方式被RNase H1识别并降解的分子机制,并提示这一过程可能参与亲本基因的转录调控。相关文章“Linking circular intronic RNA degradation and function in transcription by RNase H1”于8月25日以封面文章形式发表在SCIENCE CHINA Life Sciences 上。

研究组先前的工作揭示5’剪接位点和分支位点附近的顺式调控元件参与ciRNA的产生与稳定存在,并发现ciRNA积聚在转录位点附近,通过未知机制促进亲本基因的转录(Zhang et al., Mol Cell, 2013)。
在这项最新的研究中,通过筛选已知的核糖核酸内切酶,鉴定到RNase H1可以调控一部分ciRNAs的降解。已知RNase H1是一个特异降解R-loop结构中RNA链的核糖核酸内切酶,此项研究发现一部分ciRNA有较高的GC含量,在细胞内倾向于在其转录位点形成R-loop结构,进而被RNase H1识别并降解。在细胞内,ciRNAs定位在细胞核内并部分与RNase H1 共定位。检测新生转录本的RNA聚合酶II(Pol II)转录延伸速率(TER)发现,相比于不产生ciRNA的基因,产生ciRNA的基因TER更快。此外,体外实验揭示相比于具有相同序列的线性RNA,环形ci-ankrd52具有独特的二级结构,使其能与亲本基因DNA形成更稳定的R-loop。进一步体外竞争实验揭示其中一个被RNase H1 降解的环形RNA,ci-ankrd52与前体RNA竞争结合亲本基因DNA,提示其可能参与R-loop前体RNA的释放,有利于RNA聚合酶II(Pol II)的转录延伸。值得注意的是,由于目前缺乏特异的手段在细胞内实时监测并区分ciRNA或前体RNA形成的R-loop,以及高效特异敲除ciRNA的工具,该机制在细胞内的重要性有待进一步探索。
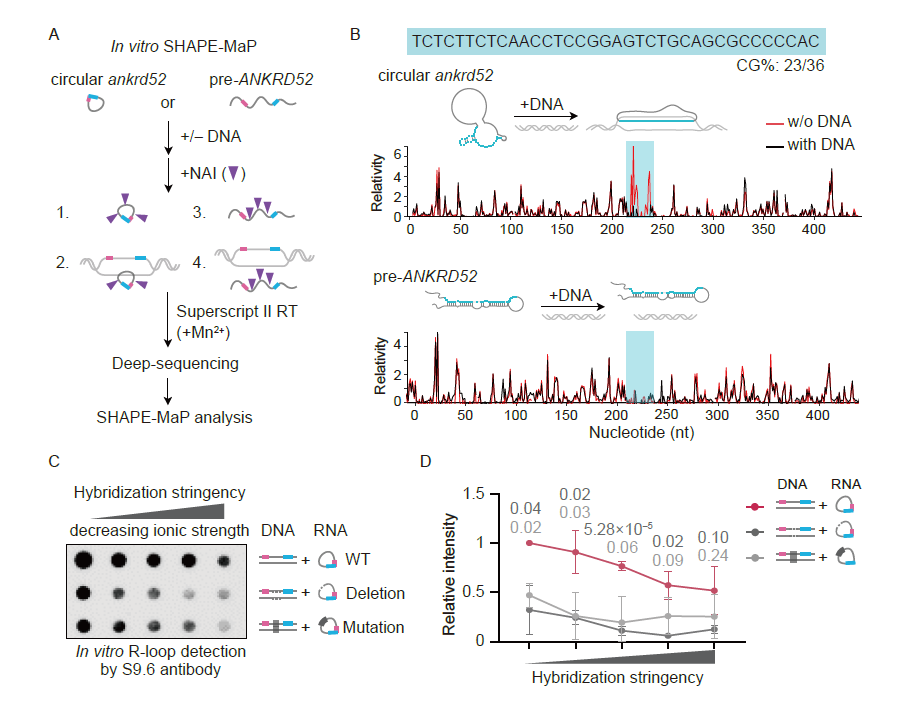 ci-ankrd52 局部“开放”的单链RNA二级结构有利于与模板DNA形成R-loop
ci-ankrd52 局部“开放”的单链RNA二级结构有利于与模板DNA形成R-loop
A 体外SHAPE-MaP方法示意图;B 环形或线性ankrd52在模板DNA存在或不存在情况下体外构象示意图;C和D删除或替换环形ankrd52“开放”的单链RNA二级结构区域(212~248 nt)抑制与模板DNA形成R-loop
国科大杭州高等研究院李响博士为该论文第一作者,陈玲玲研究员为通讯作者。陈玲玲研究组博士后张佳琳、博士研究生刘肖奇、郜祥,工作人员张君和已毕业博士生张扬参与部分工作。该研究也得到中国科学院上海营养与健康研究所(原计算生物学研究所)杨力研究员及其博士研究生雷云妮、薛蔚和南芳的大力帮助,以及清华大学孙前文教授在R-loop解析过程中的帮助。此项工作得到国家自然科学基金(批准号:91940303, 31725009,31730111, 31925011)、HHMI International Program (批准号:55008728)和中国科协青年人才托举工程(批准号:2020QNRC001)的资助。
文章在SCIENCE CHINA Life Sciences上通过绿色通道快速评审与发表,从收稿到在线发表于7个工作日内完成。
来源: 中国科学杂志社
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQ5MzQyNA==&mid=2656813180&idx=1&sn=99d09d568572917848203bca8d50df2c
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

新型基因芯片,可快速准确分析RNA表达模式

吴缅团队在环形RNA调控细胞代谢研究中取得新进展
一个小小的细胞就有多达4200万个蛋白质分子

环形RNA家族,藏着治疗红斑狼疮新靶点

学术造假必遭严惩,为何仍不断有人冒险

我科研团队发现环形RNA调控小细胞肺癌的关键信号通路

中国科大在环形RNA调控细胞代谢研究中取得新进展
中国科大在环形RNA调控细胞代谢研究中取得新进展
北京生科院建立单细胞环形RNA分析技术及表达图谱

合肥研究院发现环形RNA调控小细胞肺癌的关键信号通路