科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-09-27
但是目前临床上还缺乏有效的延缓AD病程的手段。
因此,针对AD的新靶点以及新型靶向性药物的开发是临床上亟待解决的问题。
近日,中国药科大学基础医学与临床药学学院司马健研究员团队成员在生物医学1区杂志《Theranostics》(2020 IF: 11.556)上发表论文,报道了AD模型中, TNF-α介导的神经元程序性坏死以及UVRAG关联的细胞自噬机制受损是AD发病的重要机制。
因此,靶向程序性坏死以及细胞自噬有望为AD的临床干预提供潜在的靶点。
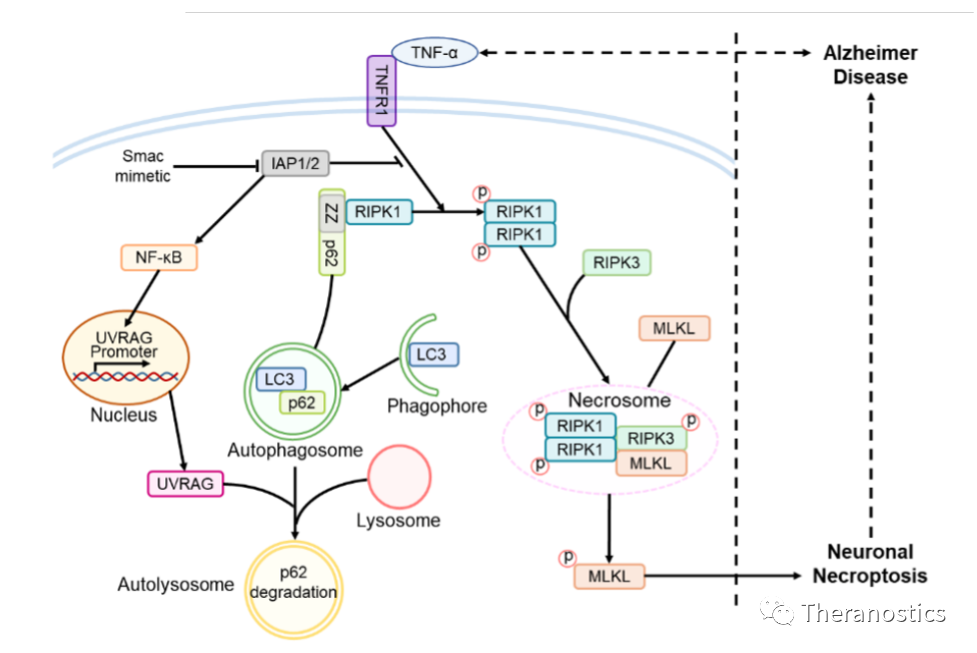
程序性细胞坏死(Necroptosis)是一种依赖于RIPK1和RIPK3激酶活性的细胞死亡方式。
死亡信号诱导RIPK3激酶的激活,进而磷酸化细胞坏死的特异性执行蛋白MLKL。
磷酸化的MLKL(p-MLKL)发生寡聚化并转位到细胞的膜结构上导致细胞膜和细胞器膜的破坏,以致细胞死亡和胞内物质的外漏。
近年,程序性细胞坏死参与神经退行性疾病如AD的发病过程已有报道,但是AD中诱导神经元坏死的起始机制仍未阐明。
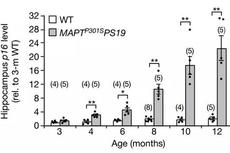
在此项研究中,研究人员采用AD患者样本、AD转基因小鼠以及细胞培养模型,发现激活神经元坏死取决于上游TNF-α/TNFR1信号,在 TNF-α刺激下,累积的 p62 招募 RIPK1并诱导其自我寡聚,并激活下游RIPK1/RIPK3/MLKL级联反应,导致神经元坏死。
p62 的异常积累是由UVRAG下调诱导的自噬流损伤引起的;值得注意的是,UVRAG 过度表达抑制了AD细胞和小鼠模型中的神经元坏死,并改善了AD小鼠的学习记忆能力。
该研究阐明了AD发展过程中调控神经元程序性坏死的一种精细调控机制,其中关联了 TNF-α信号、RIPK1/3活性以及自噬程序,为AD的治疗提供了新的思路和潜在的靶点。
中国药科大学基础医学与临床药学学院司马健研究员为文章的通讯作者,课题组成员徐翀和武佳琳为文章的并列第一作者。
参考文献:Chong Xu, Jialin Wu, Yiqun Wu, Zhichu Ren,Yuyuan Yao, Guobing Chen, Evandro F. Fang, Ji Heon Noh, Yong U. Liu, Libin Wei,Xijing Chen, Jian Sima. TNF-α-dependentneuronal necroptosis regulated in Alzheimer’s disease by coordination ofRIPK1-p62 complex with autophagic UVRAG. Theranostics.2021. 11(19): 9452-9469. 原文链接:https://www.thno.org/v11p9452.htm

来源:brainnews
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649608465&idx=5&sn=65689053410921605036bf109a42071f
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

人类大脑有多少个神经元细胞

金纳米粒子保护神经元免于细胞死亡
陈荣清/彭碧文/王云/朱沛旻 共同主持专刊 | 非神经元细胞对神经元的调节

脑损伤激活胶质细胞产生神经元研究获进展
脑损伤激活胶质细胞产生神经元

“记忆晶体管”可同时存储和处理信息

小鼠脑细胞间隙看得见
3D成像图揭示小鼠大脑神经元的复杂联系,帮助揭开大脑奥秘
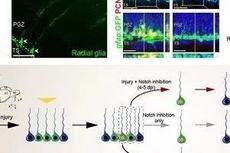
脑损伤激活胶质细胞产生神经元研究获进展
抗衰老药物清除脑内的衰老细胞:可以预防认知衰退