宫奥博
加好友
宫奥博 2021-10-08
新冠病毒SARS-CoV-2引起的新冠肺炎疫情COVID-19仍在全球范围内流行,严重威胁人类健康与公共卫生安全。新冠病毒感染人类后临床表现不一,从无症状感染到发热、疲劳、干咳、呼吸不畅,严重可出现肺炎、急性肺损伤乃至呼吸窘迫综合征和死亡。尤其是疾病严重程度与年龄与性别有一定相关性,老年人死亡率高于年轻人,男性的死亡率高于女性【1】。
建立可真实模拟病毒感染及所致疾病的小动物模型对于疫苗药物研发至关重要。然而,早期研究提示,小鼠对新冠病毒普遍不易感,通过基因编辑或敲入在小鼠体内表达人类ACE2受体,可使新冠病毒在小鼠体内建立感染,但临床表现较为轻微,无法真实模拟新冠肺炎重症临床表现【2-4】。前期工作中,秦成峰/周育森合作团队通过小鼠体内传代驯化,成功获得了全球第一个新冠病毒鼠适应株MASCp6,可在老年实验鼠中建立呼吸道感染,并导致急性肺损伤和中度炎症反应【5】。
近日,军事科学院军事医学研究院秦成峰/王慧团队联合中科院生物物理所王祥喜团队在Nature Communications发表题为Characterization and structural basis of a lethal mouse-adapted SARS-CoV-2的研究论文,成功获得了一株可对小鼠高度致死的强毒株MASCp36,建立了可模拟新冠肺炎重症的小动物模型,并从结构学角度揭示了新冠病毒跨越种属屏障从人感染小鼠的分子机制【6】。

研究人员利用前期获得的鼠适应株MASCp6,进一步通过30次连续传代,最终获得可导致100%小鼠死亡的强毒株MASCp36。MASCp36经滴鼻途径感染小鼠后,可在气管及肺组织中高效复制,II型肺泡细胞(AT2)作为其主要靶细胞。更为重要的是,MASCp36感染后第四天能够诱发坏死性肺炎与广泛弥散性肺泡损伤;肺病理切片中能观察到上皮细胞脱落、多核细胞、透明膜及包涵体等典型病变,与临床尸检病理保持一致。此外,在感染后7天发现小鼠肺动脉壁中胶原蛋白的沉积、肺泡壁增厚等病症导致纤维化。除了肺损伤之外,脾脏与肾脏也出现不同程度的损伤。
尤其值得关注的是,MASCp36的致病性与小鼠的性别和年龄密切相关,雄性、老年小鼠更为易感,其中雄性老年Balb/C小鼠的半数致死剂量仅为120 PFU(图1)。肺组织转录组及多重免疫荧光染色结果显示,年轻小鼠感染病毒后可迅速上调巨噬细胞与中性粒细胞比例,诱导大量ISGs的产生,而老年小鼠肺部募集免疫细胞更为迟缓,诱导细胞因子、淋巴细胞活化、炎症反应等,提示机体抗病毒免疫应答速度与肺损伤进展密切相关。
高通量测序发现,致死株MASCp36在连续传代过程中供累积产生了12个氨基酸突变,其中3个位点(K417N、Q493H与N501Y)位于S蛋白受体结合区(RBD)。SPR亲和力分析显示,MASCp36病毒的RBD与鼠源ACE2亲和力显著增加,而与人源ACE2亲和力明显降低。进一步通过冷冻电镜(cryo-EM)分别解析出了鼠适应株RBD与鼠源ACE2的高分辨结构。结果发现致死株MASCp36的RBD与鼠源ACE2可形成稳定结合的致密结构,与野生型病毒RBD与人源ACE2的结构高度类似。其中N501Y突变可与鼠ACE2的H352/Y41位点形成疏水区域,Q493H与鼠ACE2的N31/E35形成疏水的盐桥及氢键结合,K417N突变可与鼠ACE2的N30/Q34形成新的氢键结合,这三个位点共同作用使其与鼠源ACE2亲和力大为增加;而K417N突变破坏了与人ACE2中D30原有的盐桥,使其与人ACE2的结合力显著降低。
值得一提的是,新冠病毒小鼠传代适应过程中出现的关键突变同样反复出现在人类变异株中,呈现明显的趋同进化趋势【7】。尤其是S蛋白中3个关键氨基酸突变,更是与高度关注的变异株(VOC)高度重合。阿尔法(Alpha)、贝塔(Beta)和伽马(Gama)变异株均携带N501Y突变,德尔塔(Delta)变异株携带了K417N突变,其中贝塔变异株更是携带了K417N和N501Y两个与MASCp36一致的突变。最近,秦成峰团队也证实,临床分离的贝塔变异株与我国早期分离株不同,在进化过程中获得了感染小鼠的能力,并可导致间质性肺炎等病理损伤【8】。鉴于越来越多的动物体内检测到新冠病毒,新冠病毒在野外和家养动物中的感染和传播,尤其是变异情况,需要高度关注。
综上所述,基于致死株MASCp36的小鼠模型能够利用标准实验小鼠(如BALB/c、C57BL/6等)模拟新冠病毒感染及其所致重症临床表现,炎症反应及年龄/性别偏向性与人类疾病疾病高度类似,为疫苗、药物评价及致病机制研究提供了重要工具。更重要的是,该研究揭示了决定新冠病毒跨种传播的关键突变位点及其作用机制,为深刻理解新冠病毒在自然界中的出现和消亡提供了新的线索。
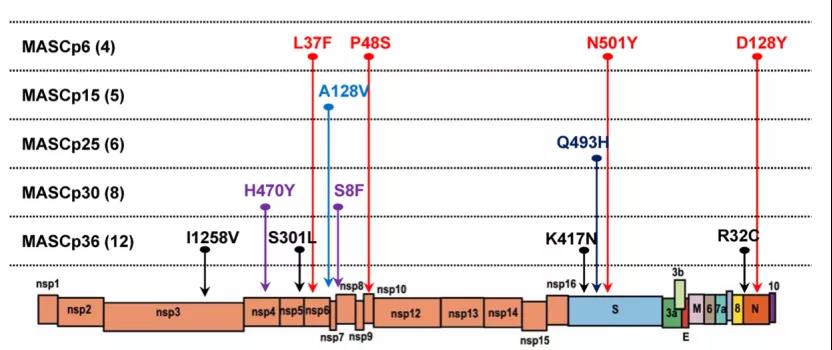
图:新冠病毒致死株MASCp36在小鼠体内连续传代过程中累积的关键氨基酸突变
军事科学院军事医学研究院孙世惠、谷宏静、陈奇、叶青、杨冠、李睿婷、范航,中科院生物物理所曹磊为论文并列第一作者。军事科学院军事医学研究院秦成峰、王慧研究员和中科院生物物理所王祥喜研究员为论文的共同通讯作者。清华大学王新泉研究员、中国疾控中心谭文杰研究员、国家蛋白质科学中心(北京)杨晓研究员为本文做出重要贡献。
原文链接:
https://www.nature.com/articles/s41467-021-25903-x
参考文献
[1]. Scully, EP, et al. Considering how biological sex impacts immune responses and COVID-19 outcomes. Nat. Rev. Immunol. 20, 442–447 (2020).
[2]. Bao, L. et al. The pathogenicity of SARS-CoV-2 in hACE2 transgenic mice. Nature 583, 830–833 (2020).
[3]. Sun, J. et al. Generation of a broadly useful model for COVID-19 pathogenesis, vaccination, and treatment. Cell 182, 734–743.e735 (2020).
[4]. Ye, Q, et al. SARS-CoV-2 infection in the mouse olfactory system. Cell Discov. 6;7(1):49 (2020)
[5]. Gu, H. et al. Adaptation of SARS-CoV-2 in BALB/c mice for testing vaccine efficacy. Science 369, 1603–1607 (2020).
[6]. Sun, S, et al. Characterization and structural basis of a lethal mouse-adapted SARS-CoV-2. Nat Commun. 12(1):5654 (2021)
[7]. Zhou, HY, et al. Convergent evolution of SARS-CoV-2 in human and animals. Protein Cell. 2021 Apr 30:1-4.
[8]. Chen, Q, et al. Transient acquisition of cross-species infectivity in the evolution of SARS-CoV-2. Natl Sci Rev. (2021)
注意!这5种药物在国外都是禁用的,国内却当成常备药!

最新研究:流感病毒有望得到遏制
新型冠状病毒肺炎疫情政策总览
新型冠状病毒肺炎——您了解吗?

新型冠状病毒肺炎预防知识



你身体里也有病毒基因:存在于众多生命中

新型冠状病毒肺炎求助通道开启

艾滋病疫苗为何“难产”?
新型肺炎疫苗研发成功,远超23价疫苗免疫范围


新型冠状病毒肺炎知识篇